ALCOHOLES Y FENOLES
Nomenclatura de Alcoholes
Introducción
En el presente trabajo se dará a conocer toda la útil información sobre los Alcoholes y Fenoles, donde se consultará y se explicará detalladamente sobre como nombrar a los Alcoholes y Fenoles, su definición, características y entre otro elementos fundamentales para su exitosa comprensión.
Objetivos
Objetivo general
Consultar toda la información que se pueda encontrar sobre esta maravillosa temática.
Objetivos específicos
- Definir de manera especifica los Alcoholes.
- Definir de manera especifica los Fenoles
- Aprender a realizar los ejercicios sobre Alcoholes y Fenoles rápidamente.
- Reconocer cada tipo de Alcohol y Fenol.
- Dar a conocer imágenes que relacionen la temática de la que se va a tratar en el blog.
- Aprender sobre los Alcoholes y Fenoles para que así la evaluación sea exitosa.
Desarrollo-Marco Teórico
Nomenclatura de Alcoholes
Los alcoholes son un grupo de moleculas organicas caracterizadas por la presencia de uno o mas grupos -OH (hidroxilo) como grupo principal. Los alcoholes tienen de formula general: R-OH, estructuralmente son semejantes al agua, en donde uno de los hidrógenos se ha sustituido por un grupo alquilo. Su grupo funcional es el grupo hidroxilo, OH.
A partir de los alcoholes, también se pueden obtener muchos compuestos con diferentes grupos funcionales. Su estructura, es similar a la del agua, solo que se reemplaza uno de los átomos de hidrógeno del agua, por un grupo alquilo.
Como todo en la vida, los alcoholes también tienen categorías, ya que encontramos los grupos hidroxilo unidos a diferentes estructuras; una forma de organizarlos, es basándose en el tipo de átomo de carbono al que esta unido, por ejemplo, si es un carbono primario, obviamente tendremos un alcohol primario. Si esta unido a un carbono secundario, sera un alcohol secundario, por lo tanto un alcohol terciario esta unido a un carbono terciario.
A partir de los alcoholes, también se pueden obtener muchos compuestos con diferentes grupos funcionales. Su estructura, es similar a la del agua, solo que se reemplaza uno de los átomos de hidrógeno del agua, por un grupo alquilo.
Como todo en la vida, los alcoholes también tienen categorías, ya que encontramos los grupos hidroxilo unidos a diferentes estructuras; una forma de organizarlos, es basándose en el tipo de átomo de carbono al que esta unido, por ejemplo, si es un carbono primario, obviamente tendremos un alcohol primario. Si esta unido a un carbono secundario, sera un alcohol secundario, por lo tanto un alcohol terciario esta unido a un carbono terciario.

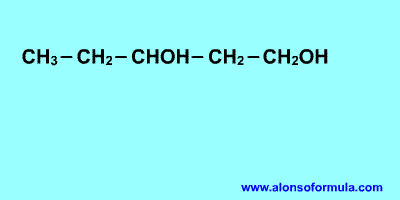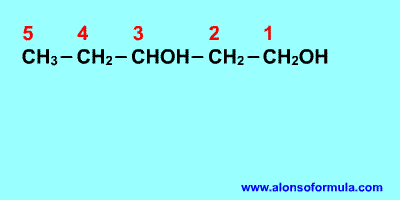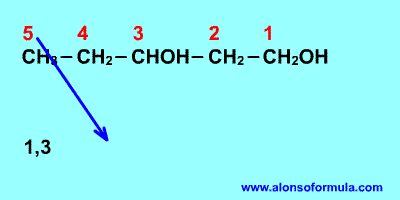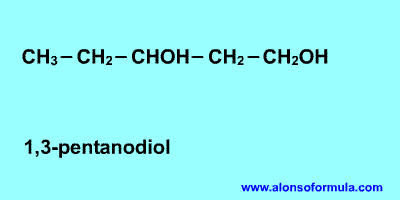
Se nombran como los hidrocarburos de los que proceden, pero con la terminación "-ol", e indicando con un número localizador, el más bajo posible, la posición del grupo alcohólico. Según la posición del carbono que sustenta el grupo -OH, los alcoholes se denominan primarios, secundarios o terciarios.
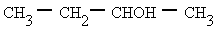
2-butanol o butan-2-ol (Normas IUPAC 1993)
Si en la molécula hay más de un grupo -OH se utiliza la terminación "-diol", "-triol", etc., indicando con números las posiciones donde se encuentran esos grupos. Hay importantes polialcoholes como la glicerina "propanotriol", la glucosa y otros hidratos de carbono.

1,2,3-propanotriol, propano-1,2,3-triol o glicerina
Cuando el alcohol non es la función principal, se nombra como "hidroxi-", indicando el número localizador correspondiente.
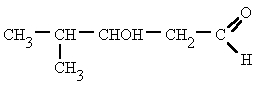
3-hidroxi-4-metilpentanal
| ||||||||||||||
Si nos dan la fórmula
Sitúa los localizadores a partir del extremo que tenga más cerca un grupo alcohol. Escribe los localizadores de los grupos OH seguidos del nombre del hidrocarburo terminado en -ol, -diol, -triol, etc. según corresponda.
| ||||||||||||||
Si nos dan el nombre
Sobre el esqueleto de átomos de carbono sitúa los grupos OH y completa con los hidrógenos.
| ||||||||||||||
Ejemplos:
Nomenclatura
La nomenclatura de alcoholes sustituye la terminación -o de los alcanos por -ol (metano, metanol; etano, etanol). En alcoholes ramificados se elige la cadena más larga que contenga el grupo -OH y se enumera de modo que se le otorgue el localizador más bajo posible.
|
Los ácidos carboxílicos y sus derivados (ésteres, haluros de alcanoílo, anhídridos, ésters, amidas y nitrilos), así como aldehidos y cetonas son grupos prioriarios frente al alcohol. Cuando la molécula tenga alguno de éstos grupos el alcohol pasa a nombrarse como -hidróxi.
Reglas
Regla 1. Se elige como cadena principal la de mayor longitud que contenga el grupo -OH.

Regla 2. Se numera la cadena principal para que el grupo -OH tome el localizador más bajo. El grupo hidroxilo tiene preferencia sobre cadenas carbonadas, halógenos, dobles y triples enlaces.
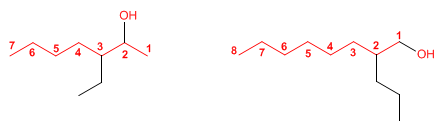
Regla 3. El nombre del alcohol se construye cambiando la terminación -o del alcano con igual número de carbonos por -ol
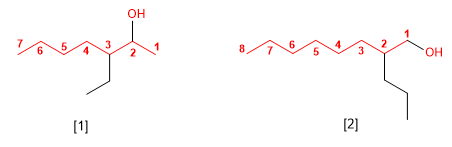
Regla 4. Cuando en la molécula hay grupos grupos funcionales de mayor prioridad, el alcohol pasa a serun mero sustituyente y se llama hidroxi-. Son prioritarios frente a los alcoholes: ácidos carboxílicos, anhídridos, ésteres, haluros de alcanoilo, amidas, nitrilos, aldehídos y cetonas.
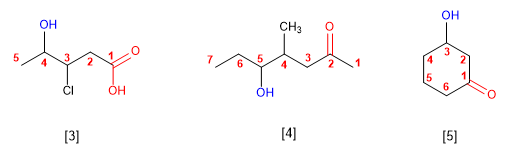
Regla 5. El grupo -OH es prioritario frente a los alquenos y alquinos. La numeración otorga el localizador más bajo al -OH y el nombre de la molécula termina en -ol.
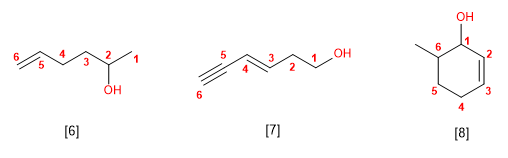
Nomenclatura de Fenoles
Los fenoles como dijimos, son compuestos que resultan de reemplazar un hidrógeno o más de su anillo aromático por uno o más OH.
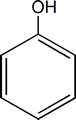
El miembro más simple e importante de esta familia es el hidroxibenceno o Fenol.
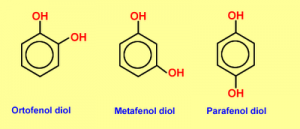
Si existen 2, 3 o más grupos OH se denominaran difenoles, trifenoles o polifenoles respectivamente. Cuando los sustituyentes del anillo estan vecinos se los llama con el prefijo orto (o). Si hay un lugar de separación entre ellos es meta (m) y si estan en lados opuestos para (p).
El fenol no existe en estado libre.
Se forma en la destilación seca de la hulla. Luego se destilan los aceites medios del alquitrán de hulla.
Por este método se obtiene poca cantidad. Por este motivo se lo prepara hoy sintéticamente.
Por este método se obtiene poca cantidad. Por este motivo se lo prepara hoy sintéticamente.
A partir de la formación del ácido bencenosulfónico:
En la primera etapa el benceno reacciona con el ácido sulfúrico:
Este ácido formado después reacciona con el sulfito de sodio, dando como producto bencenosulfonato de sodio.
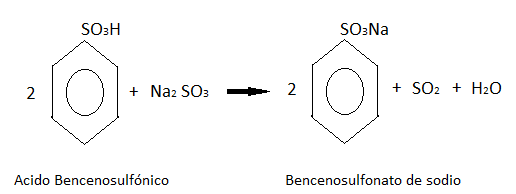
El bencenosulfonato de sodio después se concentra por evaporación y se combina con hidróxido de sodio.
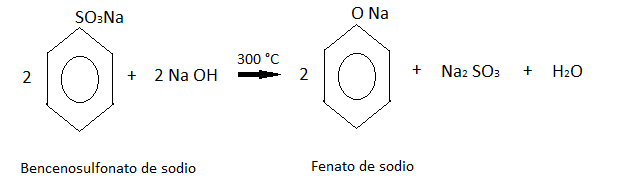
Este último producto se acidifica con dióxido de azufre de una de las reacciones anteriores, obteniendo finalmente al fenol.
Propiedades del Fenol:
Es un sólido que cristaliza como agujas incoloras de olor particular. Su temperatura de fusión es de 38°C y su punto de ebullición de 181°C. es higroscópico, es decir, absorbe mucha agua.
Se puede oxidar ante la luz adquiriendo una coloración rosada. Es cáustico.
Es poco soluble en agua. Muy soluble en éter y alcohol.
Químicamente se comporta como ácido débil. Produce por lo tanto iones hidrógeno al disociarse.
Con respecto a las reacciones, hay de dos tipos. Las que se relacionan con el grupo OH y aquellas en las que participa el anillo.
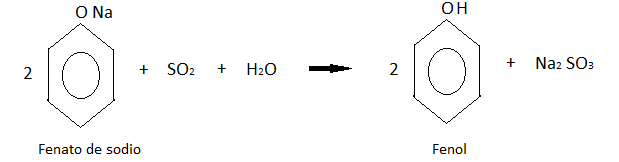
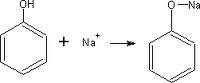
Formación de sales: El fenol al ser un ácido débil, reacciona con facilidad con una base fuerte como la del sodio, litio o potasio.
Esta reacción si bien las presentan los alcoholes alifáticos, es más débil en estos. En el caso del fenol se da con mayor tendencia.
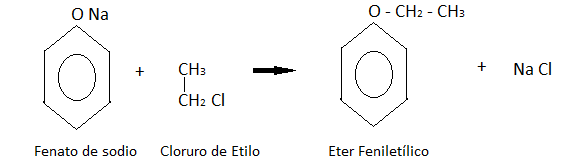
Formación de éteres: Los fenatos de sodio se tratan con halogenuros de alquilo. En este caso particular con cloruro de metilo, obteniendo el éter feniletílico como indica la reacción.
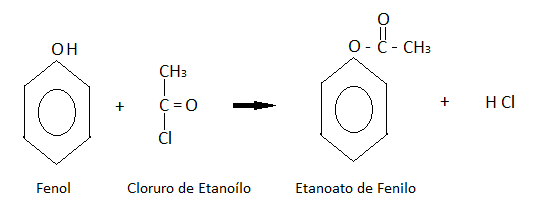
Formación de ésteres:
El fenol reacciona con cloruros derivados de ácidos orgánicos formando ésteres.
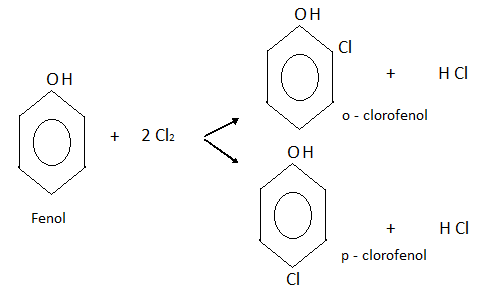
Entre las reacciones del anillo aromático, es decir, de sustitución, podemos nombrar las principales.
Halogenación:
Haciendo reaccionar al fenol con cloro, por ejemplo, se obtiene una mezcla de o-clorofenol y p-clorofenol.
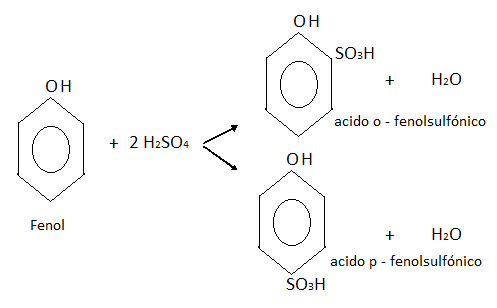
Sulfonación:
El fenol se puede combinar con el ácido sulfúrico en caliente, dando una mezcla de dos isómeros de ácido o-fenol sulfónico y p-fenol sulfónico.
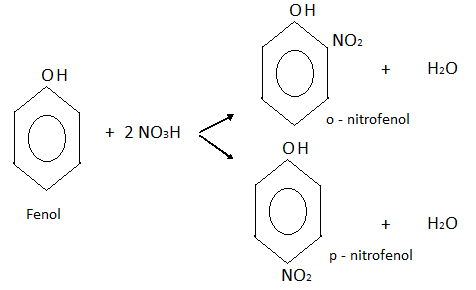
Nitración:
En este caso también se obtiene una mezcla de dos isómeros, o-nitrofenol y p-nitrofenol.
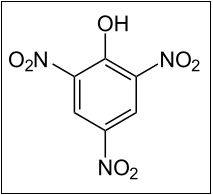
Si el ácido nítrico fuera más concentrado, obtendríamos el 2,4,6,-trinitrofenol también llamado ácido pícrico.
Usos del Fenol: Se usa para la fabricación de resinas sintéticas, ácido pícrico (usado a su vez para explosivos), ácido salicílico (materia prima para las aspirinas), colorantes, etc. Se ha usado mucho tiempo como agente antiséptico.
Para nombrar los fenoles se utiliza la terminación -ol precedida del nombre del hidrocarburo aromático correspondiente.
Si existen varios radicales -OH, se numeran los átomos de carbono del benceno de modo que los carbonos con grupos hidroxilo les corresponda la numeración más baja en conjunto, si hay varias posibilidades decidirá el orden de preferencia alfabético de los radicales.; al nombrar los polifenoles, deben escribirse los localizadores y los prefijos correspondientes: di, tri, etc. Cuando el grupo OH no es la función principal se utiliza el prefijo "hidroxi-" acompañado del nombre del hidrocarburo.
La IUPAC admite algunos nombres comunes:
Pirocatecol (1,2-bencenodiol ó 1,2-dihidroxibenceno ó o-difenol
|
Resorcinol (1,3-bencenodiol ó 1,3-dihidroxibenceno ó m-difenol)
|
Hidroquinona (1,4-bencenodiol ó 1,4-dihidroxibenceno ó p-difenol)
|
3,4-xilol (3,4-dimetilfenol)
|
Ejercicios
alcoholes 2
fenoles 1
fenoles 2





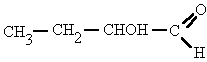
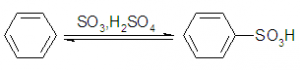



BUEN TRABAJO 5,0
ResponderEliminar