OXÍGENO (O2) E HIDRÓGENO (H2)
El Oxígeno e Hidrógeno
Introducción
A continuación vamos a estudiar y visualizar toda la información necesaria como la definición, los estados naturales, las propiedades físicas y químicas, la obtención, el reconocimiento y la aplicación sobre dos importantes elementos como lo son el Oxígeno O2 y el Hidrogeno H2.
Lo que estudiaremos hoy va a ser de gran importancia y conocimiento.
Objetivos
Objetivo general
Desarrollar un trabajo productivo basado en la información que se va a obtener de diversas páginas de investigación sobre el oxígeno y el hidrógeno, permitiéndonos aprender la necesidad de estos elementos para el ecosistema y sus diferentes características.
Objetivos específicos
Objetivos específicos
- Reconocer los estados naturales del O2 y el H2.
- Consultar las generalidades sobre el O2 y el H2.
- Definir las propiedades físicas y químicas del O2 y del H2.
- Identificar las propiedades físicas del O2 y del H2.
- Hacer una consulta adecuada sobre la combustión del O2 junto con las partes de la llama de la candela.
Marco teórico
El Oxígeno
El O2 es un elemento más pesado que el aire, donde se encuentra en estado libre. Existe, pero combinado, en el agua, en los óxidos y en casi todos los ácidos y sus sales; también forma parte de la mayoría de las substancias orgánicas.
Es de gran importancia por ser el elemento esencial en los procesos de respiración de la mayor parte de las células vivas y en los procesos de combustión. Es el elemento más abundante en la corteza terrestre. Cerca de una quinta parte (en volumen) del aire es oxígeno.
El oxígeno gaseoso no combinado suele existir en forma de moléculas diatómicas, O2, pero también existe en forma triatómica, O3, llamada ozono.
El oxígeno molecular (O2) representa el 20% de la atmósfera terrestre. Este oxígeno abastece las necesidades de todos los organismos terrestres y, cuando se disuelve en agua, cubre las necesidades de los organismos acuáticos. En el proceso de la respiración, el oxígeno actúa como aceptor final para los electrones retirados de los átomos de carbono de los alimentos. El ciclo se completa en la fotosíntesis cuando se captura la energía de la luz para alejar los electrones respecto de los átomos de oxígeno de las moléculas de agua.
Por cada molécula de oxígeno utilizada en la respiración celular, se libera una molécula de dióxido de carbono. Inversamente, por cada molécula de dióxido de carbono absorbida en la fotosíntesis, se libera una molécula de oxígeno.
Estado Natural
El Oxígeno es el elemento más abundante de la superficie terrestre, de la cual forma casi el 50%; constituye un 89% del agua y un 23% del aire (porcentajes por pesos).
En estado libre, el oxígeno se encuentra en la atmósfera en forma de moléculas diatónicas (O2), constituyendo un 23% por peso y un 21% por volumen. En combinación, entra en la formación de una gran cantidad de compuestos orgánicos y minerales, haciendo parte de todos los organismos animales y vegetales. De los minerales que contienen oxígeno, los más importantes son los que contienen silicio, siendo el más simple de todos la sílice (SiO2), que es el principal constituyente de la arena. Otros compuestos que contienen oxígeno son sulfatos, carbonatos, fosfatos, nitratos y óxidos, principalmente.
Características principales
Símbolo Atómico: O
Fórmula Molecular: O (2)
Estado Físico: Gas
Color: Incoloro
Olor: Inholoro
Sabor: Insípido
Peso Atómico: 15,9994
Peso Molecular: 31,9988
Número Masa: 16
Número Atómico: 8
Números de Oxidación: -2, -1 (en los peróxidos) y +2 (en el OF2),
Densidad (a PTN): 1,429 g/l
Punto de Fusión: -218,4o C
Punto de Ebullición: -183o C
Solubilidad: Poco Soluble
Notación Espectral: 1s 2 2s 2 2P 4
Fórmula Molecular: O (2)
Estado Físico: Gas
Color: Incoloro
Olor: Inholoro
Sabor: Insípido
Peso Atómico: 15,9994
Peso Molecular: 31,9988
Número Masa: 16
Número Atómico: 8
Números de Oxidación: -2, -1 (en los peróxidos) y +2 (en el OF2),
Densidad (a PTN): 1,429 g/l
Punto de Fusión: -218,4o C
Punto de Ebullición: -183o C
Solubilidad: Poco Soluble
Notación Espectral: 1s 2 2s 2 2P 4
Estructura Atómica: El oxígeno pertenece al grupo VI de la periódica, por tener 6 electrones de valencia y al período 2 por poseer 2 niveles de energía. En total el átomo de oxigeno tiene 8 electrones (Z=8). Su núcleo contiene 8 electrones y 8 protones.
Propiedades físicas
En condiciones normales de presión y temperatura (STP), el oxigeno se encuentra en estado gaseoso formando moléculas diatónicas (O2). Al igual que el hidrógeno, no posee propiedades organolépticas, es decir es incoloro, inodoro e insípido.
El oxigeno se condensa a -183oC en un líquido azul pálido. Se solidifica a -219oC en un sólido blando azulado. Para ambos estados de agregación es muy paramagnético, es decir, sus regiones más probables de encontrar electrones u orbitales tienden a alinearse paralelamente cuando están en presencia de un campo magnético.
Si se suministra energía al oxígeno diatómico se obtiene la otra forma alotrópica del oxigeno conocida como ozono, de acuerdo con la reacción siguiente:
3Oo (g) → 2O3 (g)
La estructura de Lewis consideraba para el oxigeno presenta electrones sin pareja que violentan la regla del octeto, pero justifican el carácter paramagnético del oxígeno molecular, de acuerdo al cual el oxígeno es atraído por un campo magnético, tanto en su estado gaseoso como en estado líquido.
El ozono no es magnético, por tanto se le considera una estructura en la cual todos los electrones están apareados.
El ozono tiene un olor fuerte y penetrante. Éste es más soluble en agua que el oxigeno debido a que las moléculas del O3 son polares, sin embargo las del O2 no lo son.
Si llevamos el ozono a una temperatura de -111.5 oC se convierte en un líquido azul intenso de carácter fuertemente explosivo. El ozono es un agente oxidante fuerte. Sus aplicaciones se basan, precisamente, en su fuerte carácter oxidante.
El ozono se usa como germicida, como decolorante de ceras, féculas, grasas y barnices.
El oxigeno tiene tres isótopos estables y diez radiactivos. Los radioisótopos tienen todos una vida media de menos de tres minutos.
Propiedad
|
Oxigeno
|
Ozono
|
| Ubicación | Se lo encuentra en la atmósfera en forma de O2 en estado gaseoso | Se lo encuentra en la atmósfera en forma de O3 en estado gaseoso |
| Densidad | 0,00143 g/cm³ | |
| Color | Incoloro gaseoso y azul licuado | Azul claro gaseoso y azul oscuro licuado |
| Olor | Inodoro | Posee un olor nauseabundo semejante al del cloro. |
| P. de ebullición | -182.5 °C | -112 °C |
| Características | La molécula de O2 es paramagnética en sus tres estados y es angular. | La molécula de O3 es diamagnética y angular (117°49’±30’). |
| Reactividad | El oxígeno, directa o indirectamente reacciona con todos los elementos de la naturaleza exceptuando el Flúor y los metales nobles (Au y Pt). La combinación de un cuerpo con oxígeno recibe el nombre de combustión. Esta combinación puede ser acompañada de un gran desprendimiento de calor. | El ozono posee las mismas propiedades químicas que el oxígeno solo que se producen mas enérgicamente. Es decir que oxidaciones con ozono se producen mayor velocidad que con oxígeno, o en condiciones que con oxígeno no son apreciables. |
| Usos | Se utiliza para las combustiones en las cuales se desea llegar a una temperatura más elevada que si se utiliza aire. Se utiliza para dar a los enfermos y para abastecer de oxígeno a los tripulantes en los aviones ultrasónicos y naves espaciales. El oxígeno se utiliza en los sopletes y principalmente para mejorar los aceros en los altos hornos. | Se utiliza como desinfectante para la fabricación de aceites secantes. Se usa como desinfectante y antiséptico en la purificación de agua potable. |
| Obtención | El oxígeno puede obtenerse a partir de la descomposición térmica de óxidos (de metales poco reactivos, de los peróxidos, algunos bióxidos y algunas oxisales). Se puede obtener por electrólisis del agua. Por destilación fraccionada del aire liquido. | El ozono puede obtenerse a partir de oxígeno molecular por calentamiento (por un filamento de platino en contacto con aire liquido) por radiación (por luz con 2.090 Å de long. de onda), eléctricamente (por descarga eléctrica silenciosa). |
Propiedades Químicas
1. Es comburente.
2. Reacciona con los no metales para formar óxidos ácidos o anhídridos.
3. Reacciona con los metales para formar óxidos básicos.
4. Reacciona con muchos de sus compuestos.
2. Reacciona con los no metales para formar óxidos ácidos o anhídridos.
3. Reacciona con los metales para formar óxidos básicos.
4. Reacciona con muchos de sus compuestos.
Reacciones químicas y compuestos
En este sentido, existen dos tipos de óxidos:
Óxido Ácido o Anhídrido: éste tiene lugar cuando un no metal se combina con el oxigeno y obedece a la siguiente ecuación:
No metal + oxígeno→ Óxido acido anhídrido.
S + O2→ SO22 (dióxido de azufre)
C + O2→ CO2 (dióxido de azufre).
Óxido básico: Este tiene lugar cuando un metal se combina con el oxigeno y obedece a la siguiente educación:
Metal + Oxígeno→ Óxido básico.
4K+ O2→ 2K O2 (Óxido de potasio).
Reacción con algunos de sus compuestos:
2BaO + O2→ 2Ba O2 (Peróxido de bario)
El oxígeno ocupa el segundo lugar dentro de la escala de electronegatividad (EN). Éste forma compuestos con todos los elementos excepto los llamados metales nobles (oro, plata y platino), y los gases nobles (helio, neón y aparentemente el argón).
Las reacciones del oxigeno con otros elementos pueden ser de tres tipos:
• Reacciones de combustión: La reacción de combustión es la reacción del oxigeno del aire con un material combustible, como lo son los hidrocarburos. Esta reacción es axotérmica, lo que significa que genera gran cantidad de calor.
• Reacciones de oxidación: La reacción de oxidación es la reacción del oxígeno del aire con cualquier elemento de la tabla periódica, ya sea metálico o no metálico. Al producto de una reacción de oxidación se llama óxido.
En este sentido, existen dos tipos de óxidos:
Óxido Ácido o Anhídrido: éste tiene lugar cuando un no metal se combina con el oxigeno y obedece a la siguiente ecuación:
No metal + oxígeno→ Óxido acido anhídrido.
S + O2→ SO22 (dióxido de azufre)
C + O2→ CO2 (dióxido de azufre).
Óxido básico: Este tiene lugar cuando un metal se combina con el oxigeno y obedece a la siguiente educación:
Metal + Oxígeno→ Óxido básico.
4K+ O2→ 2K O2 (Óxido de potasio).
Reacción con algunos de sus compuestos:
2BaO + O2→ 2Ba O2 (Peróxido de bario)
Combustión O2
El fuego es una reacción química que involucra la oxidación o combustión rápida de un material, cuando el fuego es difícil de controlar, se convierte en un incendio.
Se necesitan cuatro elementos para que exista el fuego:
Combustible:Material capaz de arder o sufrir una oxidación rápida. Puede ser sólido (forma y volumen definidos), líquido o gas. A la vez puede clasificarse como inflamable (cuando su punto de ignición es menor a 38°C), combustible (cuando el punto de ignición es mayor a 38°C) y pirofórico (cuando arde espontáneamente).
Oxígeno:Para mantener una combustión necesitamos como mínimo
16% de oxígeno. Algunas sustancias oxidantes como el nitrato de amonio tienen suficiente oxígeno en su composición química como para mantener la combustión en atmósferas deficientes de oxigeno.
Calor:Es la energía requerida para elevar la temperatura del combustible hasta el punto en que se despidan suficientes vapores que permiten que ocurra la ignición. Es el elemento que activa la combustión.
Reacción química:Es la reacción en cadena que puede ocurrir cuando los otros tres elementos están presentes en las condiciones y proporciones apropiadas.
Los productos que se presentan en un incendio son: las llamas, que producen quemaduras y actúan como fuentes de ignición (provocan la creación de fuego) por contacto o por convección y radiación; el calor, que causa que otros materiales se enciendan y por consiguiente se difunda el incendio, además puede producir fatiga; los gases, que incluyen el dióxido de carbono (CO2) y el monóxido de carbono (CO), que son muy peligrosos pues son los que más muertes han causado; y el humo, que es una forma de gas proveniente de los combustibles, tiende a imposibilitar la visión y puede convertirse en tóxico si absorbe los gases.
El fuego consume el oxígeno existente en el ambiente y como consecuencia se produce el agotamiento de oxígeno; esta situación es muy peligrosa especialmente en espacios cerrados. Las principales fuentes de calor, que generan incendios son: la electricidad, las llamas abiertas, la energía química y la energía mecánica.
Experimento
Paso 1
Paso 2
A continuación, agrega una cierta cantidad de agua en el recipiente y enciende la vela.
Paso 3
Cubre la vela con el vaso.
Paso 4
Luego de esto, la llama se hará más pequeña, dará mucho humo y se apagará. El agua del plato subirá hacia el interior del vaso.
Entonces, cuando queremos apagar una fogata, a veces lo hacemos echando arena sobre ella.
Con ellos, lo que conseguimos es impedir que el oxígeno del aire llegue a la fogata y, por consiguiente, se apague.
Cuando en las fraguas activamos el sistema de ventilación, lo que estamos consiguiendo es, que llegue más oxígeno al carbón que arde, avivándose la llama.
Partes de la llama de la candela
1. Zona de oxidación: Es la parte superior de color amarillo, que es una llama ahumante y con un bajo potencial calorífico.
2. Zona de reducción:Es la llama central que presenta un color azul tenue.
3. Cono frío: Parte inferior de la llama.
De acuerdo a la llama o flama que el mechero proporciona se puede dividir en 3 partes:
1. Llama fría: Es de color amarillo / naranja. Arde a una temperatura media de 300 ° C . Nunca se utiliza para calentar nada , sólo para demostrar que el quemador Bunsen está encendido. Se llama también “flama de seguridad”.
2. Fuego medio: También llamada la llama azul o invisible, es difícil de ver en una habitación bien iluminada. Es la llama que mas se usa. Se encuentra a unos 500 ° C.
3. Llama fuerte: Se le nombra también: “azul rugiente” . Se caracteriza por un triángulo de color azul claro en el medio y que es la única llama de la 3 que hace un ruido.
Se encuentra a unos 700 °C
El oxígeno industrialmente se puedo obtener a partir de la destilación fraccionada del aire líquido. En este procedimiento llamado método de Georges Claude se desprende primero ázoe a -193° y luego el oxígeno a -181°.
El aire esta compuesto por:
Sustancia
|
% En peso
|
% En volumen
|
|---|---|---|
| Nitrógeno (N2) |
75.51
|
68.03
|
| Oxigeno (O2) |
23.15
|
29.98
|
| Argón (Ar) |
1.29
|
0.94
|
| Dióxido de carbono (CO2). |
0.04
|
0.03
|
| Hidrogeno (H2) |
0.0007
|
0.01
|
| Helio, Kriptón y Xenón |
Vestigios
|
Un método químico es el llamado método de Lavoisier el que consiste en el calentamiento de mercurio se oxida a 360° y luego se descompone el óxido.
Hg + O  HgO
HgO
En la industria se emplea el método de Boussingault, el cual consiste en el calentamiento de barita u óxido de bario (BaO) que se calienta al aire, al rojo naciente (400° aprox.), combinándose con el Oxigeno para formar bióxido de bario.
BaO + O 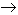 BaO2
BaO2
Calentando en seguida el bióxido de bario hacia 800°; se disocia en barita y oxígeno por la reacción inversa.
BaO2 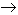 BaO + O
BaO + O
Teóricamente la barita puede servir indefinidamente pero en la práctica esto no sucede ya que el gas carbónico contenido en el aire produce carbonato de bario y por esto se debe renovar la barita periódicamente.
Se puede obtener oxígeno a partir de la electrólisis de agua alcalinizada con un 10 o 15% de NaOH. Los electrodos son de hierro. Todo se produce como si el agua estuviese descompuesta, y se recoge el oxígeno en el electrodo positivo y el hidrogeno en el electrodo negativo.
Métodos de laboratorio: Se descompone el agua oxigenada en presencia de un catalizador; se utiliza generalmente el bióxido de manganeso: MnO2.
H2O2 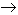 H2 O + O
H2 O + O
En lugar de utilizar H2O2, se puede utilizar el compuesto metálico correspondiente:
Na2O2 ó K2O2
Estos compuestos son destruidos por el agua:
H2O + K2O2 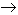 2KOH + O
2KOH + O
Se puede obtener oxígeno por calcinación de bióxido de manganeso y Clorato de potasio.
3MnO2 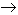 Mn3O4 + O2
Mn3O4 + O2
ClO3K 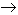 KCl + 3O
KCl + 3O
Realmente no se descompone el clorato de potasio completamente sino hasta una temperatura mucho mas elevada a una temperatura moderada la ecuación correspondiente es la siguiente:
2ClO3K 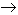 ClO4K + KCl + O2
ClO4K + KCl + O2
Para evitar este inconveniente generalmente se mezcla el clorato de potasio con bióxido de manganeso, en el cual el oxígeno se fija primero y luego inmediatamente lo abandona según las reacciones inversas:
2MnO2 + 3O 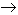 Mn2O7
Mn2O7
Mn2O7  2MnO2 + 3O
2MnO2 + 3O
Reconocimiento
Se conocen tres formas estructurales del oxígeno: el oxígeno ordinario, que contiene dos átomos por molécula y cuya fórmula es O2; el ozono, que contiene tres átomos por molécula y cuya fórmula es O3, y una forma no magnética azul pálida, el O4, que contiene cuatro átomos por molécula, y se descompone fácilmente en oxígeno ordinario. Se conocen tres isótopos estables del oxígeno: el oxígeno 16 (de masa atómica 16) es el más abundante. Representa un 99,76% del oxígeno ordinario y se utilizó en la determinación de las masas atómicas hasta la década de 1960 (véase Átomo).
El oxígeno se prepara en el laboratorio a partir de ciertas sales como el clorato de potasio, el peróxido de bario y el peróxido de sodio. Los métodos industriales más importantes para la obtención de oxígeno son la electrólisis del agua y la destilación fraccionada de aire líquido. En este último método, se licúa el aire y se deja evaporar. En el aire líquido, el nitrógeno es más volátil y se evapora antes, quedando el oxígeno en estado líquido. A continuación el oxígeno se almacena y se transporta en forma líquida o gaseosa.
Aplicación
En la vida diaria es muy común encontrar el oxígeno en la metalurgia, es decir en las construcciones de acero, debido a que la producción de acero depende del oxígeno y gracias a sus propiedades de durabilidad, resistencia y anti corrosión es un elemento fundamental.
Se utiliza para la creación del acero, para convertir el carbono en dióxido de carbono, también para reducir el óxido de hierro en hierro puro, muy utilizado para la creación de cohetes y misiles, además una de sus funciones principales es la respiración de plantas, animales y el oxígeno que inhalan los seres humanos por sus pulmones.
Cómo forma parte de los elementos no metales, una de sus principales propiedades, es conduce mal la electricidad y el calor por lo que para convertir de carbono en dióxido de carbono se emplea mucho trabajo, otra de sus propiedades es que es anti corrosión, es decir no se oxida ayuda al hierro a no oxidarse, a ser resistente y durable. Todo esto se obtiene gracias a su capacidad de ganar electrones y por su carácter electronegativo.
También ayuda a la manufactura de productos químicos por oxidación controlada, a la propulsión de cohetes, al apoyo a la vida biológica y medicina, a la minería, producción y fabricación de productos de piedra y vidrio. Existen equipos capaces de concentrar el oxígeno del aire. Son los llamados generadores o concentradores de oxígeno, que son los utilizados en los bares de oxígeno y equipos generadores de ozono, los cuales son usados para oxidación de materias, para ozonización de piscinas, etc.
El Hidrógeno
Esrimer elemento de la tabla periódica. En condiciones normales es un gas incoloro, inodoro e insípido, compuesto de moléculas diatómicas, H2. El átomo de hidrógeno, símbolo H, consta de un núcleo de unidad de carga positiva y un solo electrón. Tiene número atómico 1 y peso atómico de 1.00797. Es uno de los constituyentes principales del agua y de toda la materia orgánica, y está distribuido de manera amplia no sólo en la Tierra sino en todo el universo. Existen 3 isótopos del hidrógeno: el protio, de masa 1, que se encuentra en más del 99.98% del elemento natural; el deuterio, de masa 2, que se encuentra en la naturaleza aproximadamente en un 0.02%, y el tritio, de masa 3, que aparece en pequeñas cantidades en la naturaleza, pero que puede producirse artificialmente por medio de varias reacciones nucleares.
El hidrógeno se quema en el aire formando una llama azul pálido casi invisible. Es el más ligero de los gases conocidos en función de su bajo peso específico con relación al aire. Por esta razón, su manipulación requiere de cuidados especiales para evitar accidentes. propenso a fugas debido a viscosidad y a su bajo peso molecular.
Estado Natural
moléculas orgánicas
El hidrógeno en estado libre sólo se encuentra en muy pequeñas cantidades en la atmósfera, aunque en el espacio interestelar abunda en el Sol y otras estrellas, siendo de hecho el elemento más común en el Universo.
En combinación con otros elementos, se encuentra ampliamente distribuido en la Tierra, en donde el compuesto más abundante e importante del hidrógeno es el agua, H2O. El hidrógeno se halla en todos los componentes de la materia viva y de muchos minerales. También es parte esencial de todos los hidrocarburos. Todos los ácidos contienen hidrógeno.
Propiedades físicas
El hidrógeno es un gas incoloro, inodoro e insípido a temperatura ambiente. Es el elemento más liviano que existe, siendo aproximadamente 14 veces menos pesado que el aire. Su molécula consiste de dos átomos de hidrógeno (H2) unidos por un enlace covalente. Posee tres isótopos, de los cuales el más abundante es el Protio (99.985%); el Deuterio tiene una abundancia de 0,02% y el tritio es tan escaso que de cada 109 átomos de hidrógeno hay uno de tritio.
El hidrogeno es fácilmente absorbido por ciertos metales finamente divididos, siendo los principales paladio, platino y oro. Por ejemplo, uno volumen de paladio finamente dividido puede adsorber aproximadamente 850 volumen es de Hidrógeno a temperatura ambiente. El hidrógeno absorbido es muy activo químicamente.
Propiedades químicas
Número atómico
1
Valencia
1
Estado de oxidación
+1
Electronegatividad
2,1
Radio covalente (Å)
0,37
Radio iónico (Å)
2,08
Radio atómico (Å)
-
Configuración electrónica
1s1
Primer potencial de ionización (eV)
13,65
Masa atómica (g/mol)
1,00797
Densidad (g/ml)
0,071
Punto de ebullición (ºC)
-252,7
Punto de fusión (ºC)
-259,2
Descubridor
Boyle en 1671
Métodos Industriales:
- Reacción de hidrocarburos o carbón con vapor de agua. (Exot): La separación es por enfriamiento o por absorción en una aleación de Ag−Pd. Se puede usar otro gas o carbon.
- Electrólisis del agua: Se obtiene hidrógeno de elevada pureza. En medio ácido, en medio alcalino y electrólisis del NaCl.
- Descomposición térmica del agua: Proceso endotérmico si es directa . Si es indirecta, el proceso consta de cuatro etapas: (750ºC) (100ºC) (25ºC) (500ºC)
- Destilación de la hulla: se separa por enfriamiento de los demás gases (CO, N2, CH4..)
Métodos de laboratorio:
- Por electrólisis
- Reducción del ion H+: − Agua + metal = hidróxido u óxido + H2. Se interrumpen por formación de un compuesto insoluble o por pasivado del metal.
− Acido + metal = sal + H2.
- Oxidación del ion H−: − Hidruro salino + agua = hidróxido + H2
- Excitación en frío: Efectuando una descarga eléctrica en un tubo que contiene H2. Mucha pureza
- Excitación a bajas P y T: El Hs se somete a irradiación
- Excitación a bajas P y T: El Hs se somete a irradiación
- Excitación en caliente: Con el soplete de Langmuir.
La producción de hidrógeno es un procedimiento muy simple y corresponde a una reacción característica: se sumerge un trozo de zinc en una solución de ácido clorhídrico no muy diluida. La reacción que se produce es:
Zn (s) +2 HCl (ac) --> ZnCl2 (ac) + H2 (g)
(es posible realizar la reacción análoga con magnesio, Mg)
El test característico para reconocer hidrógeno corresponde a acercar al tubo donde se está produciendo este gas un fósforo encendido; al tomar contacto con el hidrógeno ocurre una explosión muy pequeña que apaga la llama del fósforo.
Aplicación
El hidrógeno reacciona con una gran variedad de elementos no metálicos. Se combina con nitrógeno en presencia de un catalizador, formando amoníaco; con azufre formando sulfuro de hidrógeno; con cloro formando cloruro de hidrógeno y con oxígeno para formar agua.
Para que se produzca la reacción entre oxígeno e hidrógeno a temperatura ambiente se necesita la presencia de un catalizador como el platino finamente dividido. Si se mezcla con aire u oxígeno y se prende, explota.
También, se combina con ciertos metales como sodio y litio, formando hidruros. Actúa como agente reductor de óxidos metálicos como el óxido de cobre, extrayendo el oxígeno y dejando el metal en estado puro.
Se obtiene en el laboratorio por la acción de ácidos diluidos sobre los metales, como el cinc, y por electrólisis del agua. Industrialmente se producen grandes cantidades de hidrógeno a partir de los combustibles gaseosos. El hidrógeno se separa del vapor de agua, del gas natural y del gas de hulla, bien por licuación de los demás componentes del gas, bien por conversión catalítica del monóxido de carbono en dióxido de carbono, que resulta fácilmente extraíble.
El H2 es un producto derivado importante en muchas reacciones de electrólisis. Se emplean grandes cantidades de hidrógeno en la elaboración del amoníaco y en la síntesis de alcohol metílico. La hidrogenación de aceites para producir grasas comestibles, la de la hulla para producir petróleo sintético, y la que tiene lugar en el refinado del petróleo, requieren grandes cantidades de hidrógeno.
Es el gas menos pesado que existe y se ha utilizado para inflar globos y dirigibles. Sin embargo, arde fácilmente y varios dirigibles, como el Hindenburg, acabaron destruidos por incendios. El helio, que tiene un 92% de la capacidad de elevación del hidrógeno, y además no es inflamable, se emplea en su lugar siempre que es posible. Normalmente, el hidrógeno se almacena en cilindros de acero bajo presiones de 120 a 150 atmósferas. También se usa el hidrógeno en sopletes para corte, fusión y soldadura de metales.
Conclusiones
- El H2 y el O2 son primordiales para la vida ya que contienen características fundamentales para la supervivencia de los mismos.
- Sus aplicaciones son muy variadas e importantes .
- Los dos se obtienen de una manera similar a través de la electrólisis.
- Los dos se combinan con facilmente con elementos variados-
- Estos dos elementos son gases y no son tangibles.
Webgrafía
https://tintero.com.ar/index.php/site/article?slug=oxigeno-e-hidrogeno&category=enciclotin-lectura
https://www.enciclopediadetareas.net/2011/04/propiedades-fisicas-del-oxigeno.html
https://www.enciclopediadetareas.net/2010/09/estado-natural-del-oxigeno.htmlv
https://br.vexels.com/png-svg/previsualizar/142297/pulmes-humanos-respirao-oxignio-corpo-humano
https://www.enciclopediadetareas.net/2011/04/propiedades-quimicas-del-oxigeno.html
http://www.revistaseguridadminera.com/emergencias/combustible-oxigeno-calor-y-reaccion-quimica-un-tetraedro-peligroso/
http://www.santiagoapostol.net/FQ/oxigeno.htm
http://analisisinorganico.blogdiario.com/categoria/partes-de-la-llama/
https://www.textoscientificos.com/quimica/oxigeno
http://andreamoreno451.blogspot.com
http://ww2.educarchile.cl/portal.herramientas/sitios_educativos/planificador/activ/37.htm
https://www.atlascopco.com/es-ar/compressors/CustomerBenefit/Industrial-gases/Applications/oxygen-applications
http://studylib.es/doc/67462/tema-1--hidrógeno-estado-natural
https://www.lenntech.es/periodica/elementos/h.htm#ixzz5OZYk66q6
http://andreamoreno451.blogspot.com
http://ww2.educarchile.cl/portal.herramientas/sitios_educativos/planificador/activ/37.htm
https://www.atlascopco.com/es-ar/compressors/CustomerBenefit/Industrial-gases/Applications/oxygen-applications
http://studylib.es/doc/67462/tema-1--hidrógeno-estado-natural
https://www.lenntech.es/periodica/elementos/h.htm#ixzz5OZYk66q6

















Comentarios
Publicar un comentario