INFORME LABORATORIO: AROMÁTICOS
Informe de Laboratorio
Introducción
En el presente trabajo se va a dar a conocer toda la información sobre los Aromáticos donde se explicará cada una de sus características, definiciones, nomenclatura y clases de una manera concreta y fácil de comprender, junto con sus elementos principales y propiedades, siendo así que después que se expliquen junto a ellos se vean ejemplos para que su comprensión sea exitosa.
Objetivos
Objetivo general
Consultar toda la información que se pueda encontrar sobre esta maravillosa temática.
Objetivos específicos
- Definir de manera especifica los Aromáticos.
- Aprender a realizar los ejercicios sobre Aromáticos rápidamente.
- Reconocer cada tipo de Aromático.
- Dar a conocer imágenes que relacionen la temática de la que se va a tratar en el blog.
- Aprender sobre los Aromáticos para que así la evaluación sea exitosa.
Marco Teórico
Los hidrocarburos aromáticos , son hidrocarburos cíclicos, llamados así debido al fuerte aroma que caracteriza a la mayoría de ellos, se consideran compuestos derivados del benceno, pues la estructura cíclica del benceno se encuentra presente en todos los compuestos aromáticos.
Los compuestos aromáticos son sistemas clínicos que poseen una gran energía de resonancia y en los que todos los átomos del anillo forman parte de un sistema conjugado único.
Un hidrocarburo aromático es un polímero cíclico conjugado que cumple la Regla de Hückel, es decir, que tienen un total de 4n+2 electrones pi en el anillo.
Los compuestos aromáticos abarcan una amplia gama de sustancias químicas de uno dos o más anillos altamente insaturados de fórmula CnHn que poseen propiedades químicas singulares.
La aromaticidad no es un atributo de los compuestos de C e H solamente, sino que también en su estructura pueden encontrarse otros átomos como oxígeno y nitrógeno constituyendo la gran familia de los compuestos heterocíclicos aromáticos.
Hay una gran estabilidad química asociada a la estructura del benceno y en general a todos los compuestos aromáticos. Esto es debido a que son estructuras químicas cíclicas, planas que poseen un número máximo de dobles enlaces conjugados permitiendo así una amplia deslocalización electrónica en su sistema.
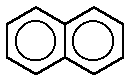
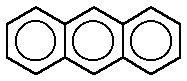
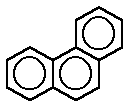
Todos los derivados del benceno, siempre que se mantenga intacto el anillo, se consideran aromáticos. La aromaticidad puede incluso extenderse a sistemas policíclicos, como el naftaleno, antraceno, fenantreno y otros más complejos, incluso ciertos cationes y aniones, como el pentadienilo, que poseen el número adecuado de electrones π y que además son capaces de crear formas resonantes.El benceno se caracteriza por una inusual estabilidad, que le viene dada por la particular disposición de los dobles enlaces conjugados.
Propiedades Químicas
La sustitución aromática puede seguir tres caminos; electrofilico, nucleofilico y de radicales libres. Las reacciones de sustitución aromáticas más corrientes son las originadas por reactivos electrofilicos. Su capacidad para actuar como un dador de electrones se debe a la polarización del núcleo Bencénico. Las reacciones típicas del benceno son las de sustitución. Los agentes de sustitución más frecuentemente utilizados son el cloro, bromo, ácido nítrico y ácido sulfúrico concentrado y caliente.
Halogenación
El cloro y el bromo dan derivados de sustitución que recibe el nombre de haluros de arilo.
C6H6 + Cl2 C6H5Cl + HCl Clorobenceno
C6H6 + Br2 C6H5Br + HBr Bromobenceno
La halogenación está favorecida por la temperatura baja y algún catalizador, como el hierro o tricloruro de aluminio, que polariza al halógeno X ± para que se produzca enérgicamente la reacción. Los catalizadores suelen ser sustancias que presentan deficiencia de electrones.
Sulfonación
Cuando los hidrocarburos bencénicos se tratan con ácido sulfúrico fumante (ácido sulfúrico que contiene anhídrido sulfúrico) H2SO4 + SO3 se forman compuestos característicos que reciben el nombre de ácidos sulfónicos. En realidad, se cree que el agente activo es el SO3
C6H6 + HOSO3H C6H5SO3H + H2O Ácido benceno sulfónico
Nitración
El ácido nítrico fumante o también una mezcla de ácidos nítrico y sulfúricos (mezcla sulfonítrica), una parte de ácido nítrico y tres sulfúricos, produce derivados nitrados, por sustitución. El ácido sulfúrico absorbe el agua producida en la nitración y así se evita la reacción inversa:
C6H6 + HONO2 C6H5NO2 + H2O Nitro -benceno
Combustión.
El benceno es inflamable y arde con llama fuliginosa, propiedad característica de mayoría de los compuestos aromáticos y que se debe a su alto contenido en carbono.
2 C6H6 +15 O2 12CO2 + 6H2O
Hidrogenación
.
El núcleo Bencénico, por catálisis, fija seis átomos de hidrógeno, formando el ciclohexano, manteniendo así la estructura de la cadena cerrada.
C6H6 + 3H2 C6H12
Síntesis de Friedel y Crafts, Alquilación
El benceno reacciona con los haluros de alquilo, en presencia de Cloruro de aluminio anhidro como catalizador, formando homólogos.
C6H6 + CH3Cl C6H5CH3 + HCl Tolueno
El ataque sobre el anillo bencénico por el ion CH3 electrofilico es semejante al realizado por el ion Cl en la halogenación.
Síntesis de Wurtz – Fitting.
Es una modificación de la de Wurtz de la serie grasa. Los homólogos del benceno pueden prepararse calentando una solución etérea de un halogenuro de alquilo y otro de arilo con sodio.Este método tiene la ventaja sobre el de Friedel – Crafts, de que se conoce la estructura del producto y puede introducirse fácilmente cadenas largas normales.
Propiedades Físicas
La serie aromática se caracteriza por una gran estabilidad debido a las múltiples formas resonantes que presenta.Muestra muy baja reactividad a las reacciones de adición. El benceno es una molécula plana con un alto grado de saturación lo cual favorece las reacciones de sustitución. Es un líquido menos denso que el agua y poco soluble en ella.Es muy soluble en otros hidrocarburos. El benceno es bastante tóxico para el hombre.
Estructura del Benceno
Cada carbono tiene tres electrones enlazados y el cuarto localizado en gira alrededor del anillo.
Una característica de los hidrocarburos aromáticos como el benceno, es la coplanaridad del anillo o la también llamada resonancia, debida a la estructura electrónica de la molécula. Al dibujar el anillo del benceno se le ponen tres enlaces dobles y tres enlaces simples. Dentro del anillo no existen en realidad dobles enlaces conjugados resonantes, sino que la molécula es una mezcla simultánea de todas las estructuras, que contribuyen por igual a la estructura electrónica. En el benceno, por ejemplo, la distancia interatómica C-C está entre la de un enlace σ (sigma) simple y la de uno π(pi) (doble).
Estructuralmente, dentro del anillo los átomos de carbono están unidos por un enlace sp2 entre ellos y con los de hidrógeno, quedando un orbital π perpendicular al plano del anillo y que forma con el resto de orbitales de los otros átomos un orbital π por encima y por debajo del anillo.
Nomenclatura del Benceno
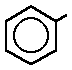
Reciben este nombre debido a los olores intensos, normalmente agradables, que presentan en su mayoría. El nombre genérico de los hidrocarburos aromáticos mono y policíclicos es"areno" y los radicales derivados de ellos se llaman radicales "arilo". Todos ellos se pueden considerar derivados del benceno, que es una molécula cíclica, de forma hexagonal y con un orden de enlace intermedio entre un enlace sencillo y un doble enlace. Experimentalmente se comprueba que los seis enlaces son equivalentes, de ahí que la molécula de benceno se represente como una estructura resonante entre las dos fórmulas propuestas por Kekulé en 1865.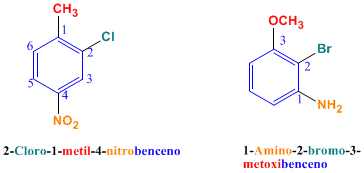

Nomenclatura de compuestos Aromáticos:

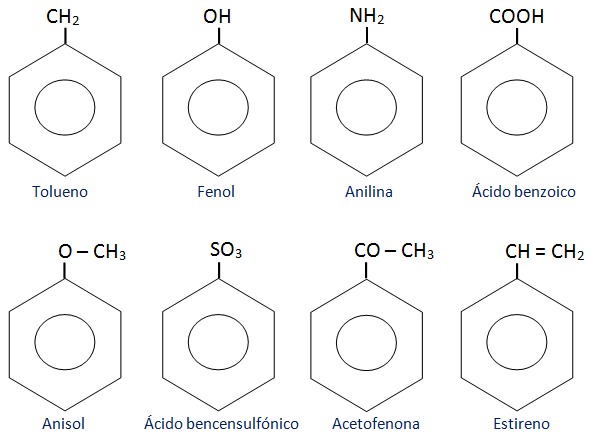
Resultan de la sustitución de un hidrógeno del anillo bencénico por restos hidrocarbonados que se denominan cadenas laterales. En este caso el anillo bencénico se representa como C6H5-, fórmula que corresponde a un benceno que ha perdido un hidrógeno y en cuyo lugar existe otro sustituyente.
Se conocen muchos derivados de sustitución del benceno. Cuando se trata de los compuestos monosustituidos, las posiciones en el anillo bencénico son equivalentes.
Se nombran terminando el nombre del sustituyente en benceno. Para aquellos grupos que se nombran solo como prefijos, el prefijo se antepone al nombre de la estructura.
Algunos derivados monosustituidos del benceno tienen nombres comunes ampliamente aceptados. Como en los compuestos alifáticos, utilizamos comas para separar números y guiones para separar números y palabras.

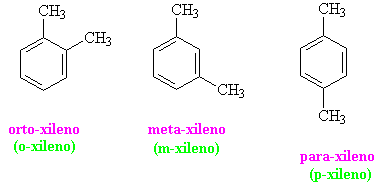
Cuando el anillo bencénico tiene dos hidrógenos sustituidos sus posiciones relativas se indican mediante números o prefijos. Tomando como ejemplo el dimetilbenceno o xileno.
Se nombran con los términos:
En bencenos disustituidos se emplean los prefijos orto (benceno 1,2-disustituido), meta (benceno 1,3-disustituido) y para (benceno 1,4-disustituido) para indicar la posición de los sustituyentes en el anillo.


Con este nombre se conocen los derivados aromáticos en los cual se han remplazado 3 o más hidrógenos por otros grupo o átomos.
En estos casos es necesario numerar el anillo bajo las siguientes reglas:
El número 1 corresponde al radical con menor orden alfabético.
La numeración debe continuarse hacia donde este el radical más cercano para obtener la serie de números más pequeña posible. Si hay dos radicales a la misma distancia, se selecciona el de menor orden alfabético; si son iguales se toma el siguiente radical más cercano.
Todos los átomos de carbono deben numerarse, no solo los que tengan sustituyente.
Al escribir el nombre se ponen los radicales en orden alfabético terminando con la palabra benceno.
Ejemplos:

El número 1 corresponde al bromo que es el radical de menor orden alfabético. Se numera hacia la derecha porque en ese sentido quedan los números más pequeños posibles.
1-bromo-3-etil-4-metilbenceno

El número 1 coresponde al radical de menor orden alfabético, que es el n-butil. La numeración se continúa hacia la derecha porque el sec-butil tiene menor orden que el ter-butil y ambos están a la misma distancia del número 1
1-n-butil-2-sec-butil-6-ter-butilbenceno
Si nos dan la fórmula
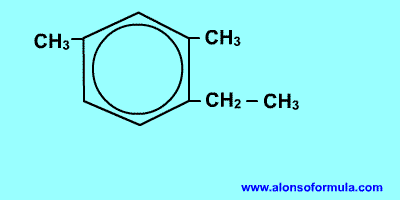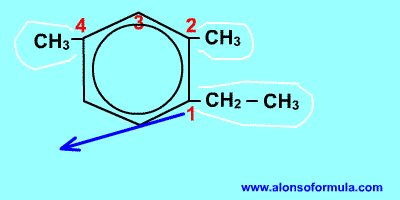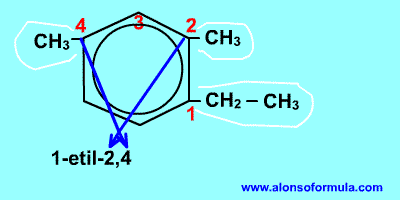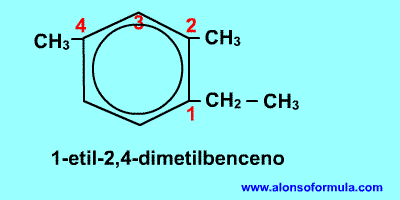
Sitúamos los localizadores sobre los carbonos del benceno consiguiendo que los localizadores de los radicales sean los más bajos posible. Ordenamos los radicales por orden alfabético y luego escribimos benceno.
Si nos dan el nombre 
Coloca los localizadores sobre los carbonos del benceno. Sitúa los radicales sobre los carbonos correspondientes y completa la fórmula con los átomos de hidrógeno.
Ejemplos:
|
Ejercicios































































Links
Segundo link
Tercer Link
Cuarto Link











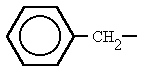



Comentarios
Publicar un comentario