LABORATORIO DE QUIMICA
Neutralización, pH y titulación
Introducción
En el presente trabajo se va a realizar una extensa y profunda investigación sobre la neutralización, el pH y la titulación donde vamos a identificar las distintas definiciones, características y objetivos de los que se va a estudiar, identificando las distintas imágenes que se nos van a mostrar, los procedimientos y los ejercicios realizados en la página virtual Yenka.
Objetivos
- Identificar las distintas maneras de medir el pH.
- Relacionar las diferentes situaciones que se van a plantear en el presente trabajo.
- Diferenciar los tres temas que se van a tratar para su mayor comprensión
- Profundizar a cerca de cada tema, sus características, imágenes, tipos, entre otras cosas.
Neutralización

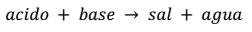
| Neutralización |
Sal disuelta
| |||||||
Ácido fuerte
|
+
|
Base fuerte
|
→
|
Agua
|
+
|
Sal
|
Anión inerte + Catión inerte
| |
Ácido fuerte
|
+
|
Base débil
|
→
|
Agua
|
+
|
Sal
|
Ácido /Base conjugados + Anión inerte
| |
Ácido débil
|
+
|
Base fuerte
|
→
|
Agua
|
+
|
Sal
|
Ácido/Base conjugados + Catión inerte
| |
Ácido débil
|
+
|
Base débil
|
→
|
Agua
|
+
|
Sal
|
Ácido/Base conjugados + Ácido/Base conjugados
| |
La neutralizacion son las reacciones entre un ácido y una base, con el fin de determinar la concentración de las distintas sustancias en la disolución.Tienen lugar cuando un ácido reacciona totalmente con una base, produciendo sal y agua. Sólo hay un único caso donde no se forma agua en la reacción, se trata de la combinación de óxido de un no metal, con un óxido de un metal.
Ácido + base → sal + agua
Por ejemplo: HCl + NaOH → NaCl + H2O
Las soluciones acuosas son buenas conductoras de la energía eléctrica, debido a los electrolitos, que son los iones positivos y negativos de los compuestos que se encuentran presentes en la solución.
Una buena manera de medir la conductancia es estudiar el movimiento de los iones en una solución.
Cuando un compuesto iónico se disocia enteramente, se le conoce como electrolito fuerte. Son electrolitos fuertes por ejemplo el NaCl, HCl, H2O (potable), etc, en cambio, un electrolito débil es aquel que se disocia muy poco, no produciendo la cantidad suficiente de concentración de iones, por lo que no puede ser conductor de la corriente eléctrica.
Cuando tenemos una disolución con una cantidad de ácido desconocida, dicha cantidad se puede hallar añadiendo poco a poco una base, haciendo que se neutralice la disolución.
Una vez que la disolución ya esté neutralizada, como conocemos la cantidad de base que hemos añadido, se hace fácil determinar la cantidad de ácido que había en la disolución.
En todos los procesos de neutralización se cumple con la “ley de equivalentes”, donde el número de equivalentes del ácido debe ser igual al número de equivalentes de la base:
Nº equivalentes Ácido = nº equivalentes Base
Los equivalentes dependen de la Normalidad, que es la forma de medir las concentraciones de un soluto en un disolvente, así tenemos que:
N= nº de equivalentes de soluto / litros de disolución
Deduciendo : nº equivalentes de soluto = V disolución . Normalidad
Si denominamos NA, como la normalidad en la solución ácida y NB, la normalidad de la solución básica, así como VA y VB, como el volumen de las soluciones ácidas y básicas respectivamente:
NA.VA= NB. VB
Esta expresión se cumple en todas las reacciones de neutralización. Ésta reacción se usa para la determinar la normalidad de una de las disolución, la ácida o la básica, cuando conocemos la disolución con la que la neutralizamos, añadimos así, poco a poco un volumen sabido de la disolución conocida, sobre la solución a estudiar, conteniendo ésta un indicador para poder así observar los cambios de coloración cuando se produzca la neutralización.
El valor del pH, definido como el – log[H+], cuando los equivalentes del ácido y de la base son iguales, se le conoce como punto de equivalencia. El punto de equivalencia puede ser práctico, o teórico.
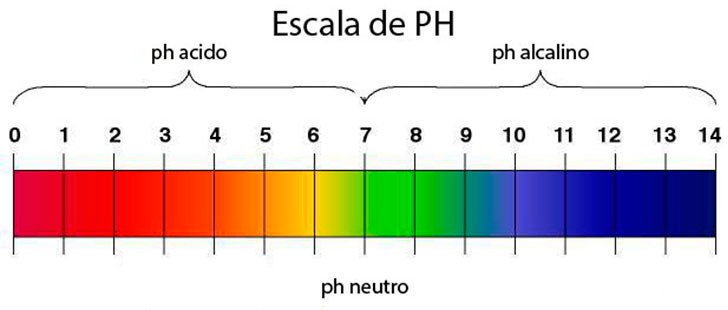
En el pH, la escala del 0 al 7, es medio ácido, y del 7 al 14, medio básico, siendo el valor en torno al 7, un pH neutro.
Si valoramos la reacción entre un ácido fuerte y una base fuerte, el punto equivalente teórico estará en torno a 7, produciéndose una total neutralización de la disolución. En cambio, si se estudia un ácido débil con una base fuerte, la sal que se produce se hidrolizará, añadiendo a la disolución iones OH-, por lo tanto el punto de equivalencia será mayor que 7. Y si es el caso de un ácido fuerte con una base débil, la sal que se produce se hidroliza añadiendo los iones hidronios, siendo asi el punto de equivalencia menos que 7.
Cuanto más cerca se encuentren los valores de los puntos teóricos y prácticos, menor será el error cometido.
Características
En primer lugar, se debe enfatizar que si una reacción de neutralización se inicia con cantidades iguales del ácido y de la base (en moles), cuando finaliza dicha reacción se obtiene solamente una sal; es decir, no hay cantidades residuales de ácido o base.
Además, una propiedad muy importante de las reacciones ácido-base es el pH, el cual indica qué tan ácida o básica es una solución. Este se determina por la cantidad de iones H+ que se encuentran en las soluciones medidas.
Por otro lado, existen varios conceptos de acidez y basicidad dependiendo de los parámetros que se tomen en consideración. Un concepto que destaca es el de Brønsted y Lowry, que considera un ácido como una especie capaz de donar protones (H+) y una base como la especie capaz de aceptarlos.
Titulaciones ácido-base
Para estudiar apropiadamente y de manera cuantitativa una reacción de neutralización entre un ácido y una base se aplica una técnica llamada titulación (o valoración) ácido-base.
Las titulaciones ácido-base consisten en determinar la concentración de ácido o base necesaria para neutralizar una cantidad determinada de base o ácido de concentración conocida.
En la práctica, se debe añadir gradualmente una solución patrón (cuya concentración se conoce con exactitud) a la solución cuya concentración se desconoce hasta que se alcance el punto de equivalencia, donde una de las especies ha neutralizado de manera completa a la otra.
El punto de equivalencia se detecta mediante el cambio violento de color del indicador que se ha añadido a la solución de concentración desconocida cuando se ha completado la reacción química entre ambas soluciones.
Por ejemplo, en el caso de la neutralización del ácido fosfórico (H3PO4) habrá un punto de equivalencia por cada protón que se desprenda del ácido; es decir, se tendrán tres puntos de equivalencia y se observarán tres cambios de coloración.
Concepto básicos a tener en cuenta:

Los ácidos fuertes, son aquellas sustancias que se disocian totalmente, cuando se disuelven en agua. Son ácidos fuertes el H2SO4, HCl, HNO3, etc.
pH= -log [H+] = -log[ Ac. Fuerte]
Ácidos de fuerza media: son aquellos que se disocian parcialmente, sus constantes ácidas o de disociación son mayores de 1 x 10^-3
Ácidos débiles: Son aquellos que no se disocian completamente. Cuando más pequeña es la constante ácida, más débil es la acidez.
Bases fuertes: se disocian totalmente, cediendo todos sus OH-. Bases fuertes son los metales alcalinos, y alcalinotérreos como pueden ser NaOH, KOH, Ba(OH)2, etc
pH= 14 + log [OH-]
Bases débiles: Se trata de aquellas que no se disocian completamente.
Existen unas sustancias, llamadas indicadores, que generalmente son ácidos orgánicos débiles, éstas poseen la propiedad de cambiar de color cuando cambia la acidez de la disolución donde se encuentran.
Por ejemplo, el papel tornasol, cambia a color azul al ser introducido en una disolución de carácter básico, y a color rojo, si la disolución es ácida.
Productos de una reacción de neutralización
En las reacciones de un ácido fuerte con una base fuerte se lleva a cabo la neutralización completa de las especies, como en la reacción entre el ácido clorhídrico y el hidróxido de bario:
2HCl(ac) + Ba(OH)2(ac) → BaCl2(ac) + 2H2O(l)
Así que no se generan iones H+ u OH– en exceso, lo cual significa que el pH de las soluciones de electrolitos fuertes que se han neutralizado está intrínsecamente relacionado con el carácter ácido de sus reactantes.
Por el contrario, en el caso de la neutralización entre un electrolito débil y uno fuerte (ácido fuerte + base débil o ácido débil + base fuerte) se obtiene la disociación parcial del electrolito débil y aparece la constante de disociación del ácido (Ka) o de la base (Kb) débil, para determinar el carácter ácido o básico de la reacción neta mediante el cálculo del pH.
Por ejemplo, se tiene la reacción entre el ácido cianhídrico y el hidróxido de sodio:
HCN(ac) + NaOH(ac) → NaCN(ac) + H2O(l)
En esta reacción el electrolito débil no se ioniza notablemente en la solución, por lo que se representa la ecuación iónica neta de la siguiente manera:
HCN(ac) + OH–(ac) → CN–(ac) + H2O(l)
Esta se obtiene luego de escribir la reacción con los electrolitos fuertes en su forma disociada (Na+(ac) + OH–(ac) en el lado de los reactantes, y Na+(ac) + CN–(ac) en el lado de los productos), donde solo el ion sodio es un espectador.
Finalmente, en el caso de la reacción entre un ácido débil y una base débil no se produce dicha neutralización. Esto se debe a que ambos electrolitos se disocian de manera parcial, sin dar como resultado el agua y la sal esperados.
Ejemplos
Ácido fuerte + base fuerte
Se tiene como ejemplo la reacción dada entre el ácido sulfúrico y el hidróxido de potasio en medio acuoso, según la siguiente ecuación:
H2SO4(ac) + 2KOH(ac) → K2SO4(ac) + 2H2O(l)
Puede observarse que tanto el ácido como el hidróxido son electrolitos fuertes; por lo tanto, se ionizan completamente en la solución. El pH de esta solución dependerá del electrolito fuerte que esté en mayor proporción.
A continuación se presentan dos gráficas en las que se observa la titulación de la reacción de neutralización de un ácido fuerte con una base fuerte y de una base fuerte con un ácido fuerte, donde se representa también su punto de equivalencia:

La neutralización del ácido nítrico con el amoníaco da como resultado el compuesto nitrato de amonio, como se muestra a continuación:
HNO3(ac) + NH3(ac) → NH4NO3(ac)
En este caso no se observa el agua producida junto a la sal, debido a que se tendría que representar como:
HNO3(ac) + NH4+(ac) + OH–(ac) → NH4NO3(ac) + H2O(l)
De modo que sí puede observarse el agua como producto de la reacción. En este caso, la solución tendrá un pH esencialmente ácido.
Ácido débil + base fuerte
Seguidamente se muestra la reacción que se da entre el ácido acético y el hidróxido de sodio:
CH3COOH(ac) + NaOH(ac) → CH3COONa(ac) + H2O(l)
Como el ácido acético es un electrolito débil se disocia parcialmente, dando como resultado acetato de sodio y agua, cuya solución tendrá un pH básico.
Ácido débil + base débil
Por último y como se dijo anteriormente, una base débil no puede neutralizar un ácido débil; tampoco sucede al contrario. Ambas especies se hidrolizan en solución acuosa y el pH de la solución dependerá de la “fuerza” del ácido y de la base.
El pH

El pH es una medida de la acidez y de la alcalinidad de una sustancia. Tiene un rango que va desde 0 a 14. Una sustancia con pH entre 0 y 7 es una sustancia ácida y una sustancia entre 7 y 14 es una sustancia alcalina. El agua potable tiene un pH entre 6 y 9. Fuera de esos valores sería perjudicial para la salud, puesto que sería corrosiva. Cuando 2 sustancias tienen diferente pH (siendo una ácida y la otra alcalina) crean una reacción. Uno de los productos conocidos más ácidos sería el ácido clorhídrico (con pH menor de 1) y uno de los más alcalinos que conocemos sería la lejía (con pH cercano a 14).
El PH es el Potencial de Hidrógeno. Es una medida para determinar el grado de alcalinidad o acidez de un disolución. Con el PH determinamos la concentración de hidrogeniones en una disolución. Un hidrogenión es un ion positivo de Hidrógeno, es un “cachito con carga positiva” del Hidrógeno.
La formula matemática para calcular el PH es el logaritmo negativo en base 10 de la actividad de los iones hidrógeno. pH = –log[aH+]
Es decir, será mas ácido cuantos más actividad de “cachitos con cargas positivas” de Hidrógeno exista en la disolución. Cuando haya menos actividad la muestra, sera alcalina.

Importancia
El índice de la escala de pH es muy importante en procesos químicos, biológicos, industriales y en general en la vida cotidiana. La diferencia entre la lluvia normal y la lluvia ácida sólo se expresa a través del pH. El pH no sólo sirve como índice de contaminación del agua de lluvia y como diagnóstico para una enfermedad corporal (al medir el pH de la orina o de la sangre), sino que además nos puede indicar el grado de contaminación de un terreno.
El control del pH en procesos químicos industriales también tiene importancia y llega a ser capital, por ejemplo, en el proceso de elaboración de la cerveza, que sólo puede generarse bajo las condiciones de un pH ácido. Para poder mantener un control adecuado del pH en este tipo de procesos es sumamente importante contar con indicadores confiables.
En FARBE cuenta con indicadores de pH como la antocianina y el rojo de metilo, entre otros, así como con una gran variedad de colorantes naturales para la industria farmacéutica, alimenticia y textil.
¿Cómo se mide?
Escala de pH
El PH normalmente lo medimos en una escala de 1 a 14. El uno seria el valor mas ácido. El 14 el valor mas alcalino. Y el 7 el valor neutro. Normalmente se usan 2 tipos de instrumentos para medir el PH.
Reactivos de PH
Los reactivos de PH los podemos encontrar en tiras o en gotitas. Su uso es muy fácil. Se echan algunas gotitas en la muestra y dependiendo del color que coja el liquido podremos determinar si es ácido, alcalino o neutro. Con las tiras el procedimiento es muy similar, hay que mojar las tiras y cambiaran de color. Es muy fácil utilizar y para empezar siempre recomendamos este método.

Test de PH Universal
El pH-Metro
El pH-metro es un potenciómetro que mide el PH entre dos electrodos. Un electrodo suele ser de plata o cloruro de plata y el otro suele ser vidrio que es sensible a los hidrogeniones.

Medidor de pH Checker Hi 98103- Hanna
Son llamadas sustancias ácidas, que son las sustancias que tienen un pH menor que 7 tienen una serie de propiedades comunes que las hacen muy fácil de distinguir:
Las sustancias ácidas tienen sabor agrio o ácido, como los cítricos, el vinagre, o la aspirina (ácido acetil salicílico).
Reaccionan con las bases (sustancias alcalinas) en reacciones ácido – base, dando una sal y agua.
Los ácidos reaccionan con metal formando sal e hidrógeno, H2. Hay que tener cuidado en la reacción de un ácido con un metal por esta generación de hidrógeno. Aquí puedes ver la reacción entre Al y HCL.
Con óxidos metálicos reaccionan para producir una sal y agua. De esta forma los ácidos suelen ser buenos para la limpieza de la corrosión.
Producen quemaduras en la piel.
Conducen la electricidad en disolución
pH ALCALINO
Las sustancias con pH mayor que 7, son las llamadas sustancias alcalinas o básicas y tienen también características comunes, que son:
Las sustancias alcalinas se disuelven en agua.
Reaccionan con los ácidos en las llamadas reacciones ácido – base, dando de resultado una sal y agua.
Tienen un sabor algo amargo
Son conductores eléctricos
Disuelven la grasa, y por ello son utilizados en jabones. Pero un pH elevado es irritante para la piel
Algunos ejemplos de bases conocidas son la lejía, amoniaco, detergente, hidróxido de sodio.
¿Que es un indicador de pH?
Los indicadores de pH son fundamentales para determinar la cantidad de pH que se encuentra en un medio específico. Cuando se habla del concepto de pH, este representa la concentración de iones de hidronio (H3O+) que se encuentra presente en una solución acuosa.
Asimismo, se mide en una escala logarítmica negativa entre 0 y 14, donde las soluciones con pH menores a 7 se consideran ácidas, las de pH mayores a 7 son básicas y las de pH igual a 7 se consideran soluciones neutras. Este parámetro se expresa de la siguiente manera con la ecuación de Henderson-Hasselbalch: pH = pKa + log10 ([A–]/[HA]).

En la expresión anterior, el pKa representa el logaritmo negativo de la constante de disociación de ácidos, y las concentraciones molares [A–] y [HA] son las del ácido débil y su base conjugada, respectivamente. Conocer el pH permite estudiar la calidad del agua y los alimentos, y poder mantener la repetibilidad de un producto químico elaborado.
Tipos
Existen tres tipos principales de indicadores de pH: indicadores líquidos ácido-base, que funcionan según un rango determinado de pH; los papeles y otros materiales indicadores que cambian de color según se le añada muestra líquida o gaseosa en su superficie; y los pH-metros digitales, que miden la diferencia eléctrica potencial entre dos electrodos.
Indicadores líquidos
Los indicadores líquidos son ácidos o bases orgánicas débiles que poseen colores variantes según su forma ácida o básica. Estos trabajan dentro de rangos limitados, variando de color una vez se alcanza este, y dejando de variar el color cuando se alcanza el nivel máximo del rango.
Para que funcionen deben ser usados únicamente en soluciones donde se pueda observar un cambio de color (preferiblemente incoloras).
Existe un gran número de indicadores líquidos de distintos colores y rangos de pH, incluyendo el rojo de cresol (rojo a amarillo en un rango de 0,2 a 1,8), el rojo de metilo (rojo a amarillo en un rango de 4,2 a 6,2), verde bromocresol (rosado a azul/verde de 4,2 a 5,2), y la fenolftaleína (incolora a rosada en un rango de 8,0 a 10,0).
Estos indicadores son populares para las titulaciones en la química analítica, aunque se debe tener cierto nivel de entrenamiento para llevar a cabo esta práctica de manera precisa.
Papeles indicadores
Existen varios tipos de papeles utilizados para la medición del pH, pero el más conocido es el llamado papel tornasol, el cual es elaborado con un polvo que proviene de líquenes.
El papel tornasol sirve para conocer si una solución líquida o gaseosa es ácida o básica (sin saber cuál será su pH exacto o un estimado del mismo), y viene en dos presentaciones: azul y rojo.
El papel tornasol azul cambia a rojo en condiciones ácidas, y el papel tornasol rojo cambia a azul en condiciones básicas o alcalinas, pudiendo reciclarse para realizar la prueba de manera inversa una vez el papel ya haya cambiado el color.
Las limitaciones conocidas del papel —como su incapacidad de ofrecer un valor exacto o estimado del pH y la habilidad de cambiar a otros colores cuando reacciona con ciertos compuestos— ha hecho que haya sido reemplazado por los indicadores líquidos y/o pH-metros.
pH-metros
Los pH-metros nacen de la necesidad de los analistas de laboratorio de conseguir valores exactos de este parámetro, algo que no era posible con los indicadores de papel ni los indicadores líquidos.
Se basan en la medición del diferencial de potencial eléctrico entre el pH del electrodo y el electrodo de referencia.
El funcionamiento de estos medidores de pH se explica con más profundidad en la sección siguiente, pero en general estos indicadores se consideran los más precisos por excelencia, brindando un número preciso (a la exactitud de 0,01 unidades de pH) del parámetro y contando con una sensibilidad y rapidez superior a los otros dos métodos.
Además, también pueden medir otras características, como sólidos disueltos, conductividad eléctrica y temperatura de la solución.
La única desventaja de este tipo de medidores de pH es que son equipos delicados y, además de una calibración inicial que debe realizar un instrumentista o conocedor del equipo, también necesitarán ser limpiados regularmente para evitar que los electrodos sufran acumulación de material en estos.
¿Cómo funcionan?
Indicadores líquidos
Los indicadores líquidos cambian de color por acción de la protonación o desprotonación en su estructura (dependiendo de la naturaleza básica o ácida del indicador), la cual se basa en el equilibrio de la reacción, así: HIn + H2O ↔ H3O+ + In–
Papeles indicadores
Los papeles indicadores, en específico el papel tornasol, deben entrar en contacto con la solución a analizar de manera discreta para poder medir con precisión.
Es decir, en una solución líquida este no debe ser introducido por completo en ella, sino que deberá ser goteado con esta o tocar brevemente una muestra de la sustancia.
En el caso de una solución gaseosa, el gas debe pasar sobre la superficie del papel para permitir que haga contacto y este cambie de color.
pH-metros
Como se dijo anteriormente, los pH-metros funcionan por la diferencia eléctrica potencial entre un electrodo de pH y uno de referencia.
El pH-metro mide el voltaje que existe entre dos electrodos en una solución y muestra el resultado convertido en un valor de pH correspondiente.
El equipo en sí consiste en un par de electrodos —uno de los cuales es metálico e insensible al pH de la solución— y un amplificador electrónico sencillo. Para su calibración, el equipo es calibrado con soluciones de pH conocido.
INDICADORES pH
Fenolftaleina
Es un indicador de pH que en soluciones ácidas permanece incoloro, pero en presencia de bases se torna rosa o violeta. Es un sólido blanco, inodoro que se forma principalmente por reacción del fenol, anhídrido ftálmico y ácido sulfúrico (H2SO4); sus cristales son incoloros.
El cambio de color está dado por la siguiente ecuación química :H2Fenolftaleína Ácido Incoloro↔Fenolftaleína2-AlcalinoRosa↔Fenolftaleína(OH)3 Muy AlcalinoIncoloro NO ES SOLUBLE EN AGUA, con lo que normalmente se disuelve en alcohol para su uso en experimentos. La fenolftaleína es un ácido débil que pierde cationes H+ en solución. La molécula de fenolftaleína es incolora, en cambio el anión derivado de la fenolftaleína es de color rosa. Cuando se agrega una base la fenolftaleína (siendoesta inicialmente incolora) pierde H+ formándose el anión y haciendo que tome coloración rosa.
Indicador universal
Es una solución formada por una mezcla de compuestos que presenta un indicador de base ácido; permite medir la acidez o alcalinidad de un medio con el cambio de color al cambiar el pH de la impresión en un rango que va del 1 al 14. El cambio de color se debe a un cambio estructural inducido por la protonación de la especie de interés. Es posible apreciar un cambio de color cuando la concentración del componente ácido es al menos 10 veces superior al componentebásico o viceversa.Los indicadores universales comerciales son las variaciones de la fórmula originalpropuesta por Yamada en la revista Chemical Abstracts en1923.
←Indicador Universal de Yamada:
← *Azul de Timol (0.025g): Compuesto orgánico, sólido quebradizo verde que indica un rango de 1.2 a 2.8
*Rojo de Metilo (0.06g): Es un sólido cristalino rojo, que indica pH de 4.2 a 6.3
*Azul de boromotimol (0,3 g): Es una información cuyo principal objetivo es medir los niveles de pH a la neutralidad, en un rango que va del 6 al 7.6
*Fenolftaleína (0.5g): Disolución incolora que permite determinar pH básicos, en unrango de 8.2 en adelante, tornándose rosa intenso
*Neutralizar la disolución con NaOH 0.05M y diluirla a 1000mL con agua desechadaCon el tiempo se ha perfeccionado la fórmula de Yamada para lograr una mejor protección y una mayor escala de pH, además, se puede adquirir una solución, y se ha reactivado. capacidad de ser disuelto en medios densostiene gran utilidad en la producción de medios de cultivo bacteriológico. La fórmula más compleja y precisa del indicador universal es:
←* 0.6 g de Anaranjado de metilo y disolvente en 50 ml de agua destilada
←* 0,4 g de rojo de metilo, disolvente con etanol en 50 ml
←* 0,8 g de azul de boromotimol, disolución en 23 ml de NaOH y 50 ml de etanol
←* 0.2g de Fenolftaleína, disolver con 800mL de Etanol
←Mezclar soluciones y añadir 800 ml de etanol, almacenar en vidrio ámbar por un
Titulación
La titulación, o también conocida como valoración, tiene como objetivo determinar la concentración de una disolución ácida o básica, llamada disolución analizada o muestra problema. Esto se logra adicionando pequeños volúmenes de una disolución de concentración conocida, llamada disolución valorada.

El proceso de titulación se basa en la neutralización que se lleva a cabo entre la disolución ácida y la básica. De esta manera, si se conoce la concentración de iones H+ de la disolución valorada, se puede inferir la concentración de iones OH- de la disolución analizada. Esto se calcula a partir del volumen de disolución valorada utilizado.
En el momento en el que la concentración de H+ y OH- se igualan, se dice que se ha alcanzado el punto de equivalencia. Para determinar este punto, se utiliza un indicador que se caracteriza porque tiene colores diferentes en medio ácido y en medio básico. El punto en que cambia el color de un indicador se llama punto final. Por ende, es necesario elegir un indicador cuyo punto final corresponda o se acerque lo más posible al punto de equivalencia.
El proceso de titulación se representa gráficamente mediante una curva de valoración. Para graficarla es necesario saber el pH de la disolución analizada (eje Y) luego de la adición de pequeñas cantidades de volumen de la disolución valorada (eje X).


Por ejemplo, al titular 25 mL de NaOH de concentración 0,5M con HCl 0,5M del cual se disponen 10 mL, se debe conocer en primer lugar la cantidad de moles de cada sustancia, teniendo en consideración que los moles son iguales a la concentración molar por el volumen de solución.
Para determinar los moles de H+ se debe considerar que:
Moles H+ = Concentración de ácido x Volumen de ácido
Moles H+ = 0,5 mol/L x 0,01 L = 5 x 10-3 mol
Mientras que, para determinar los moles de OH-, se debe tener en cuenta que:
Moles OH- = Concentración de base x Volumen de base
Moles OH- = 0,5 mol/L x 0,025 L = 0,0125 mol
En este caso, considerando que los moles de ácido son menores que los moles de la base, se debe poner la base en la bureta y el ácido en el matraz. Por lo tanto, el pH de la muestra dependerá solo del ácido, cuando el volumen de la base sea igual a 0 mL. En este caso, el pH será igual a:
pH = -log 5 x 10-3
pH = 2,30
Al agregar base a la solución, por ejemplo 1 mL, se añade en el matraz una cantidad de moles específica que se calcula de la siguiente forma:
Si se añade 1 mL de base, los moles que se agregan a la muestra están dados por:
moles de OH- = Concentración de base x Volumen de base
moles de OH- = 0,5 mol/L x 0,001 L = 5 x 10-4 mol
Estos moles de OH- reaccionan con los moles de H+ presentes en el matraz formando agua. Por lo tanto, a los moles de ácido que inicialmente se tenían en el matraz, se le debe restar el ácido añadido, ya que estos, han neutralizado su efecto.
Moles de H+ = 5 x 10-3 mol – 5 x 10-4 mol = 4,5 x 10-3 mol
Al añadir 1 mL a la muestra, ahora la cantidad total de la muestra será 11 mL, por lo tanto, la nueva concentración de la muestra estará dado por:
Concentración de ácido = moles de H+/Volumen de la muestra
Concentración de ácido = 4,5 x 10-3 mol / 0,011 L = 0,409 mol/L
A partir de esto, es posible, conocer el pH de la muestra, luego de haber añadido la base, lo que estará dado por:
pH = -log 4,5 x 10-3
pH = 2,35
Por lo tanto, luego de añadir 1 mL de base a la muestra, la disolución aumento su pH
Procedimiento
Neutralización
pH-indicadores
TORNASOL
FENOLFTALEINA
UNIVERSAL
Titulación
Ejercicios
Conclusiones
- El pH es una medida de acidez o alcalinidad que indica la cantidad de iones de hidrógeno presentes en una solución o sustancia.
- La titulación también puede ser llamada como valoración.
- Se llama neutralización a la reacción que se produce entre disoluciones ácidas y básicas. Todas estas reacciones dan como producto una sal y agua.
- Los tres diferentes temas que se estudiaron son de gran utilidad a la hora de la realización de ejercicios y de preguntas que se nos formulen.
- Todo lo que se estudió es de gran profundidad y hay que tenerle dedicación y paciencia para así aprender de una manera efectiva y clara.






LOS INFORMES ERAN POR SEPARADO 4,5
ResponderEliminar