BALANCEO DE ECUACIONES
Introducción
A continuación vamos a estudiar y visualizar toda la información necesaria como la definición, paso por paso para equilibrar una ecuación,ejemplos y consejos necesarios que debemos tener en cuenta al momento de equilibrar una ecuación de la manera más fácil y eficaz.
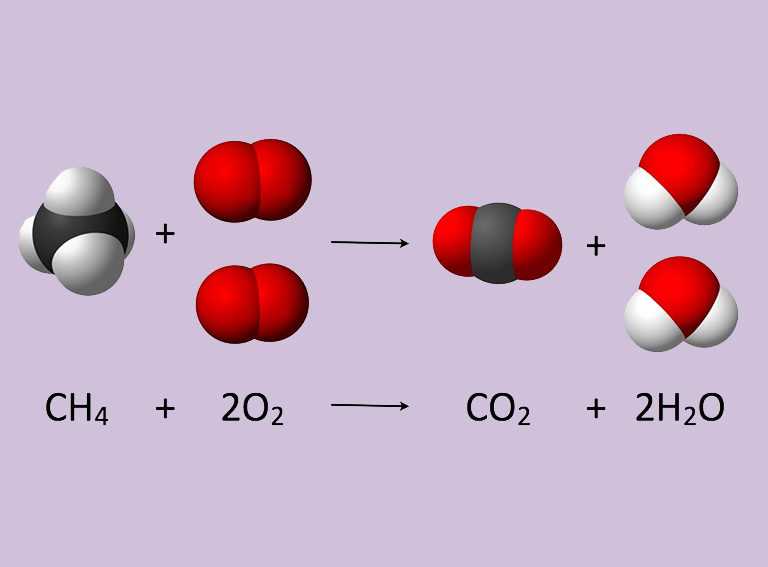
Balancear o equilibrar ecuaciones significa que debe de existir una equivalencia entre el número de los reactivos y el número de los productos en una ecuación, y eso es lo que estudiaremos hoy.
Balancear o equilibrar ecuaciones significa que debe de existir una equivalencia entre el número de los reactivos y el número de los productos en una ecuación, y eso es lo que estudiaremos hoy.
Objetivos
Objetivo general
Objetivos específicos
Desarrollar un trabajo productivo basado en la información que se va a obtener sobre las diversas maneras de balancear ecuaciones, permitiéndonos aprender por qué es necesario balancear ecuaciones cuáles son los pasos que se deben seguir y ejemplos para así balancear ecuaciones con mucha facilidad, dándole al lector y/o aprendiz opciones para que resuelva un caso en particular de éste.
Objetivos específicos
- Aprender a balancear las ecuaciones.
- Reconocer cuáles son las diferentes opciones o maneras que se adaptan a nuestro aprendizaje y que la química nos ofrece para balancear ecuaciones.
- Describir los conceptos básicos que se nos da sobre el balanceo de ecuaciones.
Marco teórico
Como en las matemáticas, una ecuación química representa una igualdad; por lo que, el número de átomos del lado de los reactivos debe ser igual al número de átomos del lado de los productos.Como los átomos tienen masa, entonces la masa total de las sustancias reactivas es igual a la masa total de los productos.Cuando en la ecuación se cumple esta condición, se cumple también la Ley de la Conservación de la Masa o Ley de Lavoisier:
“La masa no se crea ni se destruye, solo se transforma”
Para que una ecuación esté equilibrada, las sumas de las cargas eléctricas en ambos lados tienen que ser idénticas.
El principal objetivo de un balanceo es que cumpla con la Ley de conservación de la materia cumpliendo con:
"La suma de la masa de las sustancias reaccionantes debe ser igual a la suma de las masas de los productos"
Para conseguir esta igualdad se utilizan los coeficientes estequiométricos, que son números grandes que se colocan delante de los símbolos o fórmulas para indicar la cantidad de elementos o compuestos que intervienen en la reacción química. No deben confundirse con los subíndices que se colocan en los símbolos o fórmulas químicas, ya que estos indican el número de átomos que conforman la sustancia. Si se modifican los coeficientes, cambian las cantidades de la sustancia, pero si se modifican los subíndices, se originan sustancias diferentes.
Para balancear una ecuación química, se debe considerar lo siguiente:
• Conocer las sustancias reaccionantes y productos.
• Los subíndices indican la cantidad del átomo indicado en la molécula.
• Los coeficientes afectan a toda la sustancia que preceden.
• El hidrógeno y el oxígeno se equilibran al final, porque generalmente forman agua (sustancia de relleno). Esto no altera la ecuación, porque toda reacción se realiza en solución acuosa o produce sustancias que contienen agua de cristalización.
Ejemplo:
2 H2SO4
Significa que:
Hay dos moléculas de ácido sulfúrico o dos moles.
En cada molécula hay dos átomos de hidrógeno, un átomo de azufre y cuatro átomos de oxígeno.
Existen distintos métodos para balancear o equilibrar ecuaciones, como los que veremos a continuación:
Balanceo por tanteo
En este método probamos diferentes coeficientes para igualar el número de átomos de cada elemento en ambos lados de la ecuación.
En este método probamos diferentes coeficientes para igualar el número de átomos de cada elemento en ambos lados de la ecuación.
Podemos cambiar los coeficientes (los números que preceden a las fórmulas), pero no los subíndices (los número que forman parte de las fórmulas).
N2 + H2------> NH3
Pasos que se deben seguir para balancear la ecuación:
1. Se verifica si la ecuación química está balanceada; esto lo conseguimos contando la cantidad de átomos que tenemos de los elementos reactivos y comparándola con la cantidad que tenemos de producto. Si no es la misma proseguimos.
2. Primero vamos a balancear los elementos Metálicos. (Buscamos los coeficientes que nos den la misma cantidad de reactivos que de productos en los elementos metálicos. En este caso no tenemos elementos metálicos.
3. Balanceamos los elementos No metálicos. El nitrógeno es un elemento no metálico. Pero aún no ha quedado balanceada la ecuación.
4. Balanceamos los Hidrógenos. Como habíamos balanceado el No Metal, el coeficiente 2 en el amoniaco (producto), significa que tenemos en realidad 6 hidrógenos como producto así que teníamos que escribir un coeficiente en el Hidrógeno de reactivo que al multiplicarlo por dos nos diera 6. Este número es el: 3. 5.
5. Balanceamos los oxígenos.
No hay.
6. Verificamos si efectivamente está balanceada.
Sí está balanceada..
1N2 + 3H2------> 2NH3
Ejemplo: Balanceo por tanteo del ácido nítrico con el hidróxido de calcio
Ahora vamos a balancear la ecuación de la reacción del ácido nitrico con el hidróxido de calcio, la cual produce nitrato de calcio y agua:
HNO3 + Ca(OH)2 ------ > Ca(NO3)2 + H2O
1. Comenzamos contando los átomos en cada lado de le ecuación y los átomos de cada elemento de la ecuación:
1 + 1 + 3 + 1 + 2 + 2 ------ > 1 + 2 + 6 + 2 + 1
HNO3 + Ca(OH)2 ------ > Ca(NO3)2 + H2O
Lado izquierdo: N = 1; Ca = 1; O = 5; H = 3
Lado derecho : N = 2; Ca = 1; O = 7; H = 2
Comenzaremos pues nuestro balance con el nitrógeno. Del lado de las reacciones tenemos dos átomos, mientras que en los reactivos, sólo hay uno. Esto podemos equilibrarlo considerando que actúan dos moléculas de ácido nítrico, por lo que nuestra fórmula y nuestro conteo de átomos quedarían así:
2 + 2 + 6 + 1 + 2 + 2 -- > 1 + 2 + 6 + 2 + 1
2HNO3 + Ca(OH)2 ------ > Ca(NO3)2 + H2O
Lado izquierdo: N = 2; Ca = 1; O = 8; H = 4
Lado derecho : N = 2; Ca = 1; O = 7; H = 2
Ya equilibramos el nitrógeno, pero la ecuación aún está desbalanceada.
2. Observando nuestra ecuación, vemos que ya tenemos el mismo número de átomos de nitrógeno y de calcio. Esto significa que ya tenemos la cantidad adecuada de moléculas de ácido nítrico y de hidróxido de calcio para producir una molécula de nitrato de calcio. Comparando los átomos de todos los elementos, tenemos que a la ecuación de lado derecho le falta una molécula de oxígeno y dos de hidrógeno para estar equilibrada ¿Esto qué significa? Bien, pues una molécula de oxígeno y dos de hidrógeno producen agua, y como ya hay una molécula de agua presente en la reacción, significa que no es una sino dos las moléculas de agua que se producen.
Agregamos a nuestra fórmula que se producen dos moléculas de agua, y volvemos a contar átomos y elementos:
2 + 2 + 6 + 1 + 2 + 2 -- > 1 + 2 + 6 + 4 + 2
2HNO3 + Ca(OH)2 ------ > Ca(NO3)2 + 2H2O
Lado izquierdo: N = 2; Ca = 1; O = 8; H = 4
Lado derecho : N = 2; Ca = 1; O = 8; H = 4
Nuestra ecuación está correctamente balanceada. :)
Veamos los pros y contras del Balanceo por tanteo:
Balanceo por Redox
Una reacción de óxido-reducción no es otra cosa que una pérdida y ganancia de electrones, es decir, desprendimiento o absorción de energía (presencia de luz, calor electricidad, etc.) En una reacción si un elemento se oxida, también debe de existir un elemento que se reduce.
Para poder balancear por método de redox es importante recordar como determinar la cantidad de átomos de un elemento en un compuesto, así como determinar la cantidad de número de oxidación de cada elemento y conocer los pasos del método de redox.
Oxidación: Es cuando un elemento pierde electrones originando que aumente su estado de oxidación.
Reducción: Es cuando un elemento gana electrones, originando que disminuya su número de oxidación.
Reducción: Es cuando un elemento gana electrones, originando que disminuya su número de oxidación.
Procedimiento
1.Verificar que la ecuación este bien escrita y completa.
2.Colocar los números de oxidación en cada uno de los elementos.
3. Observar que números de oxidación cambiaron (un elemento se oxida y uno se reduce).
4. Escribir la diferencia de números de oxidación de un mismo elemento.
5.Multiplicar la diferencia de números de oxidación por los subíndices correspondientes de cada elemento.
6.Cruzar los resultados.
7. Colocar los resultados como coeficientes en el lugar correspondiente.
8.Completar el balanceo por tanteo.
9.Verifica la cantidad de átomos en cada miembro de la ecuación.
10.En caso de que todos los coeficientes sean divisibles se reducen a su mínima expresión.
Ejemplo:
Paso 1
Verificar que la ecuación este bien escrita y completa.
Verificar que la ecuación este bien escrita y completa.
Paso 2
Colocar los núumeros de oxidación en cada uno de los elementos y observar que números de oxidación cambiaron (un elemento se oxida y uno se reduce).
Que elemento se oxida y/o cual se reduce.
Paso 3
Escribir la diferencia de números de oxidación de un mismo elemento y multiplicar la diferencia de números de oxidación por los subíndices correspondientes de cada elemento.
Paso 4
Cruzar los resultados obtenidos en la multiplicación y colocar los resultados como coeficientes en el lugar correspondiente.
Paso 5
Completar el balanceo por tanteo y verificar la cantidad de átomos en cada miembro de la ecuación.
Recordemos :
En caso de que todos los coeficientes sean divisibles se reducen a su mínima expresión.
Veamos los pros y contras del Balanceo por Redox:
Balanceo Algebraico
Este método es un proceso matemático que consistente en asignar literales a cada una de las especies, crear ecuaciones en función de los átomos y al resolver las ecuaciones, determinando así el valor de los coeficientes.
Este método nos permite detectar si una reacción química está mal planteada, por ejemplo puede suceder que un compuesto no esté bien colocado, pues debe de estar en el otro miembro de la ecuación, esto se apreciara si alguno de los coeficientes resultar negativo al resolver el sistema de ecuaciones, por lo que resultara poco práctico en caso de que se planteara un sistema simultaneo con muchas variables y a la vez nos llevaría a una solución complicada.
Procedimiento para implementar este método:
2. Enlistar verticalmente los átomos que participan en la reacción.
3. A la derecha del símbolo de cada elemento que participa se escribe el número de veces que el elemento se encuentra en cada molécula identificada por letra.
4. Si de un lado de la reacción un elemento se encuentra en más de una molécula, se suman y se escribe cuantas veces está presente en una molécula.
5. Se sustituye la flecha por un signo igual (=).
6. Se enlistan las letras que representan las moléculas y a la letra más frecuente se le asigna el valor de uno (1).
7. Los valores de las letras se obtienen por operaciones algebraicas.
Ejemplo:
1er paso: a CaC2 + b H2O → c Ca(OH)2 + d C2H2
2do paso: Ca C O H
3er paso:
Ca: Ca está en "a" del primer miembro y en "c" en el segundo por lo tanto a=c
C: C está 2 veces en "a" y 2 veces en "d" por lo tanto 2a = 2d
O: O está en "b" y 2 veces en "c" por lo tanto b = 2c
H: H está 2 veces en "b", 2 en "c" y 2 veces en "d" por lo tanto 2b = 2c + 2d
Le asignaremos un valor numérico el cual sea conveniente a cualquiera de las variables literales. En este caso, se le asignará el valor de "1" a C
Resolvemos cada ecuación obtenida:
c = 1 luego, a = c
a = 1
2a = 2d luego, 2 x (1) = 2d
d = 2/2 = 1
b = 2c, luego b= 2 x (1); b = 2
2 b = 2 c + 2 d; 2b = 2 x (1) + 2 x (1); 2 b = 2 + 2; 2 b = 4; b = 4 / 2
b = 2
Se reemplaza cada literal por el valor obtenido:
a=1
b=2
c=1
d=1
a CaC2 + b H2O → c Ca(OH)2 + d C2H2
1 CaC2 + 2 H2O → 1 Ca(OH)2 + 1 C2H2
La ecuación balanceada quedará así: CaC2 + 2 H2O → Ca(OH)2 + C2H2.
En las reacciones químicas cuando el número de oxidación de los elementos que forman parte de los reactivos se mantiene constante en los productos; se les conoce como reacciones de metátesis. En el método REDOX se observa un cambio en el número de oxidación de las especies participantes en la reacción química y el cual es aplicable a reacciones no-iónicas. El método de ion-electrón se emplea para reacciones que se presentan en forma iónica o no iónica y que se efectúa en medios ácidos o básicos.
Reglas para balancear por el método ion-electrón.
1. Colocar los números de oxidación en los elementos que forman las moléculas.
2. Determinar que elementos son el agente oxidante y el agente reductor.
Agente oxidante: Elemento capaz de oxidar a otro y que el mismo sufre una reducción. (Gana electrones)
Agente reductor: Elemento con la capacidad de reducir a otro y que el mismo se oxida. (Pierde electrones)
3. Plantear las ecuaciones parciales correspondientes de oxidación y reducción tomando en cuenta:
a) En ambos miembros de las ecuaciones parciales, escribir los iones del agente oxidante y reductor.
b) Compuestos como óxidos, peróxidos y amoniaco se trabajan como moléculas.
c) Todos los elementos en su estado natural se escriben igual.
d) Se comienzan por balancear las semireacciones:
Ejemplo:

Se debe colocar un Coeficiente 3 en los productos porque entran 3 Cr.

4. Si la reacción ocurre en medio ácido:
a) Cada átomo de oxígeno en exceso se balancea añadiendo una molécula de agua al otro lado de la reacción.
b) Los hidrógenos se balancean añadiendo protones (H+) del lado opuesto a las moléculas de agua.
5. Si la reacción es en medio básico:
a) Los oxígenos se igualan añadiendo una molécula de agua por cada oxígeno en exceso en el mismo lado de la igualdad y 2 OH- del lado opuesto.
b) Cada átomo de hidrógeno en exceso se iguala añadiendo tantos OH- como Hidrógenos
en exceso del mismo lado de la igualdad y una molécula de agua del otro lado de la reacción.
6. Balancear las cargas netas de pérdida y ganancia de electrones.
7. Si es necesario para igualar las cargas se intercambian los valores del cambio electrónico para equilibrarlas.
8. Sumar las semi-reacciones.
9. Simplificar.
10. Si se requiere, transformar la ecuación iónica a molecular.
a) Cada átomo de oxígeno en exceso se balancea añadiendo una molécula de agua al otro lado de la reacción.
b) Los hidrógenos se balancean añadiendo protones (H+) del lado opuesto a las moléculas de agua.
5. Si la reacción es en medio básico:
a) Los oxígenos se igualan añadiendo una molécula de agua por cada oxígeno en exceso en el mismo lado de la igualdad y 2 OH- del lado opuesto.
b) Cada átomo de hidrógeno en exceso se iguala añadiendo tantos OH- como Hidrógenos
en exceso del mismo lado de la igualdad y una molécula de agua del otro lado de la reacción.
6. Balancear las cargas netas de pérdida y ganancia de electrones.
7. Si es necesario para igualar las cargas se intercambian los valores del cambio electrónico para equilibrarlas.
8. Sumar las semi-reacciones.
9. Simplificar.
10. Si se requiere, transformar la ecuación iónica a molecular.
Procedimiento
segundo nivel
Conclusiones
- Balancear una ecuación significa que debe de existir una equivalencia entre el número de los reactivos y el número de los productos en una ecuación. Lo cual, existen distintos métodos.
- Para equilibrar o balancear ecuaciones químicas, existen diversos métodos. En todos el objetivo que se persigue es que la ecuación química cumpla con la ley de la conservación de la materia.
- El método algebraico para el balanceo de ecuaciones significa que tendrás un resultado exacto. Si eres bueno en álgebra te será más rápido utilizar este método.
- Existen tres métodos básicos y eficazes para balancear ecuaciones los cuáles son Balanceo por tanteo, redox y algebraico.
- Existe un método mas que se llama ión-electrón y es un poco más complejo, éste se emplea para reacciones que se presentan en forma iónica o no iónica y que se efectúa en medios ácidos o básicos.
Webgrafía
Concepto de balanceo de ecuaciones
http://akdmia-chino51.blogspot.com.co/2009/06/balanceo-de-ecuaciones-quimicas.html
http://3bnancyrodriguezr35.blogspot.com.co/2015/08/practica-6-ley-de-la-conservacion-de-la.html
https://es.wikibooks.org/wiki/Qu%C3%ADmica/Balanceo_de_ecuaciones
Todo lo que se debe saber sobre balanceo de ecuaciones
https://es.slideshare.net/aeroscristh/balanceo-de-ecuaciones-qumicas-30434345
http://www.monografias.com/trabajos89/balanceo-de-ecuaciones-quimicas/balanceo-de-ecuaciones-quimicas.shtml
Balanceo de ecuaciones químicas
http://slideplayer.es/slide/1124601/
Ley de la conservación de la materia
https://clickmica.fundaciondescubre.es/conoce/descubrimientos/ley-la-conservacion-la-materia/
http://3bnancyrodriguezr35.blogspot.com.co/2015/08/practica-6-ley-de-la-conservacion-de-la.html
https://sites.google.com/site/quimica2proflee/balanceo-de-ecuaciones-quimicas
Ejemplo de Balanceo por tanteo
http://www.ejemplode.com/38-quimica/3946-ejemplo_de_balanceo_de_ecuaciones_por_tanteo.html
Balanceo por Redox
https://prezi.com/bnzmy15imn31/balanceo-de-ecuaciones-quimicas-por-el-metodo-redox/
http://academicoalbertocastro9.blogspot.com.co/2013/06/taller-de-balanceo-de-ecuaciones-por.html
Balanceo por método algebraico
https://cibertareas.info/metodo-algebraico-para-balancear-ecuaciones-quimica-1-4.html
https://oa.ugto.mx/oa/oa-rg-0001375/clase_2__balanceo_por_el_mtodo_algebraico.html
Ejemplo por metodo algebraico
https://brainly.lat/tarea/8082162
Reglas del balanceo ión electrón
http://zaragozaquimica1.blogspot.com.co/p/balanceo-metodo-ion-electron.html
Reglas del balanceo ión electrón
http://zaragozaquimica1.blogspot.com.co/p/balanceo-metodo-ion-electron.html




















Comentarios
Publicar un comentario